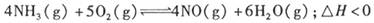题目内容
(14分)
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式 。
(2)NO2是一种 色的气体,在上述反应中作 (填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为 。
(3)上述反应中氧化剂与还原剂的物质的量之比为 ,HNO3在反应中表现出 性和 性。
(4)若反应中生成1mol的NO2,则反应中转移 mol的电子,消耗Cu g。
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式 。
(2)NO2是一种 色的气体,在上述反应中作 (填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为 。
(3)上述反应中氧化剂与还原剂的物质的量之比为 ,HNO3在反应中表现出 性和 性。
(4)若反应中生成1mol的NO2,则反应中转移 mol的电子,消耗Cu g。
(1) Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(2)红棕 还原 3NO2↑+H2O=2HNO3+NO
(3)2∶1 氧化 酸 (4)1 32
(2)红棕 还原 3NO2↑+H2O=2HNO3+NO
(3)2∶1 氧化 酸 (4)1 32
略

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
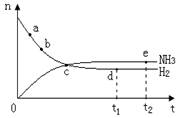
 2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )