题目内容
6.4g铜与过量的硝酸(8mol / L,60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为 n mol,此时溶液中所含NO3–物质的量为
| A.0.28mol | B.0.31mol |
| C.(n + 0.2) mol | D.(n + 0.4) mol |
C
6.4g的物质的量为:6.4g÷64g/mol=0.1mol
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.1mol x
1/2=0.1/x
解得x=0.2mol,
HNO3--H+--NO3-
1 1
nmol ymol
y=nmol,
则此时溶液中含有NO3-的物质的量为(0.2+n )mol
故选C.
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.1mol x
1/2=0.1/x
解得x=0.2mol,
HNO3--H+--NO3-
1 1
nmol ymol
y=nmol,
则此时溶液中含有NO3-的物质的量为(0.2+n )mol
故选C.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
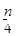 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能