题目内容
(12分)工业制硝酸的主要反应之一是:
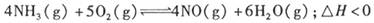
(1)若反应起始的物质的量相同,下列关系图错误的是________ (填编号)。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
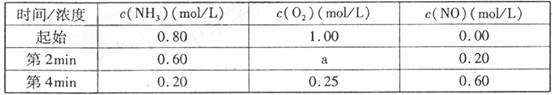
①反应在第2min到第4min时,O2的平均反应速率为________mol/(L ? min)。
②反应在第2min时改变了条件,改变的条件可能是________ (填编号)。
A 增加O2的浓度 B.升高温度 C.减小压强 D.使用催化剂
(3)将一定量铝粉和铁粉的混合物与上述反的稀硝酸充分反应,反应过程中无气体放出(氧化物产生)。在反应结束后的溶液中,滴加5mol/L的NaOH溶液,所加NaOH溶液(mL)与产生的沉淀的物质的量关系如图所示则:
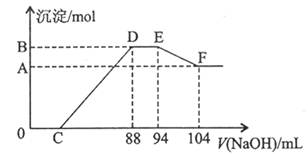
EF段反应的离子方程式是_______________;铝粉与铁粉的物质的量之比是_____________
硝酸溶液中含HNO3的物质的量是__________mol。
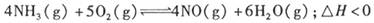
(1)若反应起始的物质的量相同,下列关系图错误的是________ (填编号)。

(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2min到第4min时,O2的平均反应速率为________mol/(L ? min)。
②反应在第2min时改变了条件,改变的条件可能是________ (填编号)。
A 增加O2的浓度 B.升高温度 C.减小压强 D.使用催化剂
(3)将一定量铝粉和铁粉的混合物与上述反的稀硝酸充分反应,反应过程中无气体放出(氧化物产生)。在反应结束后的溶液中,滴加5mol/L的NaOH溶液,所加NaOH溶液(mL)与产生的沉淀的物质的量关系如图所示则:

EF段反应的离子方程式是_______________;铝粉与铁粉的物质的量之比是_____________
硝酸溶液中含HNO3的物质的量是__________mol。
(1)AC
(2)①0.125 ②C
(3)①Al(OH)3+OH-=AlO2-+2H2O ②5:3 ③0.52
(2)①0.125 ②C
(3)①Al(OH)3+OH-=AlO2-+2H2O ②5:3 ③0.52
(1)该可逆反应是气体系数增大的放热反应,升温时平衡左移,NH3的含量增大,而H2O的含量减小,AC不正确;加压平衡左移,NO的含量减小,C正确;加入催化剂可会加快反应速率,但不影响各物质的浓度,D正确;故AC符合题意
(2)①v(NH3)= 0.1mol/(L ? min),由方程式系数比可知,v(O2)=0.125mol/(L ? min)
0.1mol/(L ? min),由方程式系数比可知,v(O2)=0.125mol/(L ? min)
②由所给数据可知,平衡正向移动:由各物质的物质的量可知,氨气与氧气转化的量符合系数比,不可能是由于加入氧气所致,排除A;升温平衡左移,排除B:减压平衡右移,符合题意,而加入催化剂不会影响平衡,排除D;故答案为C
(3)分析图像可知,在反应结束后的溶液中,包含Fe(NO3)3、Al(NO3)3及过量的HNO3,滴加5mol/L的NaOH溶液发生反应:①H++OH-=H2O ②Al3++3OH-=Al(OH)3↓ ③Fe3++3OH-=Fe(OH)3↓
由于金属与硝酸反应过程中无气体放出,且由图像可看出,DE段无沉淀生成、沉淀也不溶解,说明金属与硝酸反应的还原产物为硝酸铵,DE段反应为:④NH4++OH-=NH3·H2O
随后,Al(OH)3溶解:⑤Al(OH)3+OH-=AlO2-+2H2O
由反应⑤知,Al(OH)3溶解所耗OH-的物质的量为 =0.05mol,即Al(OH)3为0.05mol,则由铝的守恒可知,原金属混合物中铝的物质的量为0.05mol
=0.05mol,即Al(OH)3为0.05mol,则由铝的守恒可知,原金属混合物中铝的物质的量为0.05mol
由反应④知,溶液中的NH4+的量为 =0.03mol
=0.03mol
金属与硝酸反应过程中,由电子的得失守恒可得(设铁为n mol):3n+0.05×3=0.03×(5+3),则铁的物质的量为0.03mol
F点所对应的溶液为NaNO3溶液,由钠的守恒知NaNO3的物质的量为5× =0.52mol,则由氮原子的守恒可得,原硝酸溶液中硝酸的物质的量也是0.52mol
=0.52mol,则由氮原子的守恒可得,原硝酸溶液中硝酸的物质的量也是0.52mol
(2)①v(NH3)=
 0.1mol/(L ? min),由方程式系数比可知,v(O2)=0.125mol/(L ? min)
0.1mol/(L ? min),由方程式系数比可知,v(O2)=0.125mol/(L ? min)②由所给数据可知,平衡正向移动:由各物质的物质的量可知,氨气与氧气转化的量符合系数比,不可能是由于加入氧气所致,排除A;升温平衡左移,排除B:减压平衡右移,符合题意,而加入催化剂不会影响平衡,排除D;故答案为C
(3)分析图像可知,在反应结束后的溶液中,包含Fe(NO3)3、Al(NO3)3及过量的HNO3,滴加5mol/L的NaOH溶液发生反应:①H++OH-=H2O ②Al3++3OH-=Al(OH)3↓ ③Fe3++3OH-=Fe(OH)3↓
由于金属与硝酸反应过程中无气体放出,且由图像可看出,DE段无沉淀生成、沉淀也不溶解,说明金属与硝酸反应的还原产物为硝酸铵,DE段反应为:④NH4++OH-=NH3·H2O
随后,Al(OH)3溶解:⑤Al(OH)3+OH-=AlO2-+2H2O
由反应⑤知,Al(OH)3溶解所耗OH-的物质的量为
 =0.05mol,即Al(OH)3为0.05mol,则由铝的守恒可知,原金属混合物中铝的物质的量为0.05mol
=0.05mol,即Al(OH)3为0.05mol,则由铝的守恒可知,原金属混合物中铝的物质的量为0.05mol由反应④知,溶液中的NH4+的量为
 =0.03mol
=0.03mol金属与硝酸反应过程中,由电子的得失守恒可得(设铁为n mol):3n+0.05×3=0.03×(5+3),则铁的物质的量为0.03mol
F点所对应的溶液为NaNO3溶液,由钠的守恒知NaNO3的物质的量为5×
 =0.52mol,则由氮原子的守恒可得,原硝酸溶液中硝酸的物质的量也是0.52mol
=0.52mol,则由氮原子的守恒可得,原硝酸溶液中硝酸的物质的量也是0.52mol
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 He)分布情况进行探测。
He)分布情况进行探测。