题目内容
【题目】根据右图铜锌原电池示意图,回答下列问题:
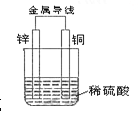
(1)该原电池总离子反应式是 。
(2)外电路电流的方向是从 (填Zn到Cu或Cu到Zn)。
(3)在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”),电路中转移电子为 mol,铜表面析出了氢气 L(标准状况下)。
【答案】
(1)Zn+2H+==Zn2++H2↑;
(2)Cu到Zn;
(3)不变, 0.1mol ,1.12L。
【解析】
试题分析:在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,电流与电子运动方向相反,溶液中阳离子移向正极,阴离子移向负极,Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑;
(1)在原电池中,较活泼金属Zn做负极,电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑;
(2)在原电池中较活泼的金属作负极,不活泼金属作正级,负极失电子,电子经导线传递到正极,电流与电子运动方向相反,因为Zn比Cu活泼,Zn做负极,Cu作正极,所以电流方向是从Cu到Zn;
(3)由于正极是氢离子得到电子,所以Cu电极质量不变,根据电极反应式Zn-2e-=Zn2+,Zn极质量变化了3.25g,说明参加反应的锌为![]() =0.05mol,所以转移电子物质的量为:0.05mol×2=0.1mol,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,2e-~H2,根据电子得失守恒可知:转移电子物质的量为0.1mol时,产生氢气0.05mol,在标况下所占体积为:0.05mol×22.4Lmol-1=1.12L。
=0.05mol,所以转移电子物质的量为:0.05mol×2=0.1mol,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,2e-~H2,根据电子得失守恒可知:转移电子物质的量为0.1mol时,产生氢气0.05mol,在标况下所占体积为:0.05mol×22.4Lmol-1=1.12L。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
, ![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
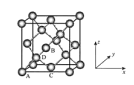
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a="565.76" pm,其密度为__________g·cm-3(列出计算式即可)。