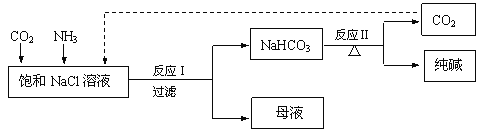
题目内容
【题目】常温下联氨(N2H4)的水溶液中有:
① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2 ,
N2H62++OH- K2 ,
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是

A. 图中Ⅲ对应的微粒为N2H62+
B. 反应②为N2H5+的水解平衡方程式
C. 若C点为N2H5C1溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. 据A点可求:K1=10-6
【答案】B
【解析】
横坐标为OH-浓度的负对数值,从左到右OH-的浓度越来越小,越能促进N2H4电离,纵坐标为微粒的物质的量分数δ(X),故Ⅰ对应的微粒为N2H4,Ⅱ对应的微粒为N2H5+,Ⅲ对应的微粒为N2H62+。
A.Ⅲ对应的OH-的浓度最小,N2H4电离平衡正向移动的程度最大,则Ⅲ对应的微粒为N2H62+,A项正确;
B. 反应②为N2H4的二级电离方程式,B项错误;
C. 由电荷守恒的:c(OH-)+c(Cl-)=c(N2H5+ )+2c(N2H62+)+c(H+),从图像可得C点c(OH-)<c(H+),故c(Cl-)>c(N2H5+ )+2c(N2H62+),C项正确;
D. 从图像可得A点N2H4、N2H5+物质的量分数相等,说明它们的浓度相等,c(OH-)=![]() ,
,![]() =
=![]() =
=![]() =
=![]() ,D项正确。
,D项正确。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目