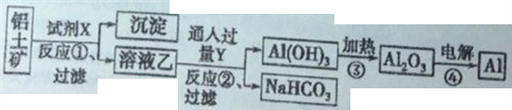
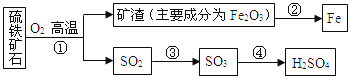
题目内容
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
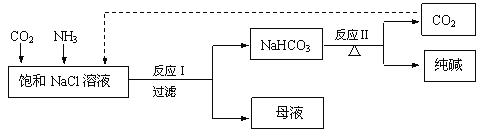
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
【答案】BaCl2溶液或Ba(OH)2溶液Na2CO3溶液Ca2+ + CO32 === CaCO3↓,Ba2+ + CO32 === BaCO3↓2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O96.4
Na2CO3 + CO2↑+ H2O96.4
【解析】(1)①加入氢氧化钠溶液的目的是为了除去Mg2+;除去SO42-用BaCl2溶液,除去Ca2+和过量的Ba2+用Na2CO3溶液,故可知步骤b中应加入BaCl2溶液或Ba(OH)2溶液,步骤c应加入过量的Na2CO3溶液;
②步骤c是加入过量的Na2CO3溶液以除去Ca2+和过量的Ba2+,故离子方程式为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
(3)NaHCO3固体加热即可分解为CO2和Na2CO3和水,方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)二氧化碳的物质的量n=![]() =0.05mol,而1molNa2CO3~1molCO2,故Na2CO3的物质的量为0.05mol,则Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g,故纯碱的质量分数=
=0.05mol,而1molNa2CO3~1molCO2,故Na2CO3的物质的量为0.05mol,则Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g,故纯碱的质量分数=![]() ×100%=96.4%。
×100%=96.4%。