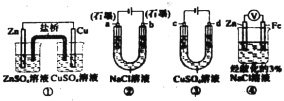
题目内容
【题目】下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A. Na2O+H2O=2NaOH B. Cl2+H2O=HCl+HClO
C. C+H2O=CO+H2 D. 2F2+2H2O=4HF+O2
【答案】B
【解析】A、反应Na2O+H2O=2NaOH不是氧化还原反应,A错误;B、反应Cl2+H2O=HCl+HClO中氯元素化合价部分升高,部分降低,氯气既是氧化剂也是还原剂,水既不是氧化剂,也不是还原剂,B正确;C、反应C+H2O=CO+H2中氢元素化合价降低,得到电子,水是氧化剂,C错误;D、反应2F2+2H2O=4HF+O2中氧元素化合价升高,失去电子,水是还原剂,D错误,答案选B。

 阶梯计算系列答案
阶梯计算系列答案【题目】红矾钠(Na2Cr2O7·2H2O)广泛用作强氧化剂、鞣革剂。以铬矿石(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取红矾钠的流程如下:

已知:①CrO42-与Cr2O72-存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
②钠盐在不同温度下的溶解度(g):
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Na2SO4 | 9.0 | 19.4 | 40.8 | 48.8 | 46.7 | 45.3 | 44.1 | 43.7 |
Na2Cr2O7 | 170.2 | 180.1 | 196.7 | 220.5 | 248.4 | 283.1 | 323.8 | 385.4 |
注32.38℃以上,与饱和溶液平衡的固相为无水Na2SO4,以下则为Na2SO4·10H2O。
③Cr3+完全沉淀时pH为6.8,Cr(OH)3开始溶解时pH为12。
请回答下列问题:
(1)煅烧铬矿石时,生成Na2CrO4的化学反应方程式为_________
(2)滤渣Ⅱ的成分是__________(填化学式)。
(3)有人认为工艺流程中“用稀硫酸调pH”改为“通入过量CO2”,不需调节pH同样可以达到实验效果,理由是___________。
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________
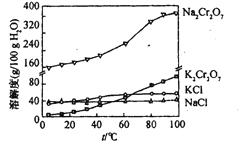
A.80 B.60 C.40 D.10
(5)该工艺所得副产品主要为无水硫酸钠并混有少量重铬酸钠,请设计从副产品获得芒硝(Na2SO4·10H2O)的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,____,过滤,洗涤,低温干燥。(实验中须使用的试剂:稀H2SO4、NaOH溶液)。
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
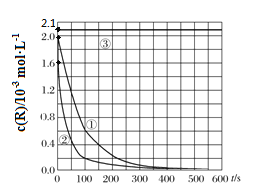
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液