题目内容
【题目】反应mA(s)+nB(g)![]() pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
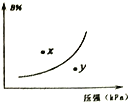
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
A. ②⑤ B. ②④ C. ①③ D. ①③⑤
【答案】A
【解析】增大压强,B%增大,说明平衡逆向移动,A为固态,所以n<p,m+n>p可能正确,③正确、①不一定正确;x点位于曲线上方,未达平衡状态,由图像看出,当B%减少时,可以趋向于平衡,则反应应是正向进行,即正反应速率大于逆反应速率,②错误;由图像可出x点的压强小于y点压强,压强越大反应速率越快,所以反应速率x点比y点时的慢,④正确;该反应为吸热反应,升高温度平衡右移,平衡常数增大,⑤错误;正确选项A。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案【题目】某实验小组同学设计实验,完成了![]() 和
和![]() 溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
实验I:
| 实验现象 |
i.加入 ii.取少量i中清液于试管中,滴加2滴1 mol/L |
已知:i.![]()
ii.![]() 的性质与卤素单质相似,且氧化性:
的性质与卤素单质相似,且氧化性:![]()
(1)![]() 和
和![]() 溶液反应的离子方程式是______。
溶液反应的离子方程式是______。
(2)现象ii中溶液最终呈红色的一种可能原因是:![]() 和
和![]() 生成(SCN)2,进而使清液中的
生成(SCN)2,进而使清液中的![]() 氧化为
氧化为![]() 。设计如下实验II进行验证:
。设计如下实验II进行验证:

① 认为原因被证实的现象iii是________。
② 加入CuCl2溶液后反应的离子方程式是_________。
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如下:

① 对比实验II,说明实验III更加严谨的原因:________。
② 改进后的实验才能证实(2)中猜想,依据的上述现象是______。
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
实验IV | 现象 |
向2 mL 1 mol/L | 充分振荡,溶液红色褪去,有白色沉淀生成 |
① 实验IV中溶液红色褪去,不能说明![]() 反应完全。结合实验II或III,说明理由:_______。
反应完全。结合实验II或III,说明理由:_______。
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有![]() 的是_______(填序号)。
的是_______(填序号)。
a.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
b.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
c.选择一种只与![]() 反应的试剂,观察是否出现特征现象
反应的试剂,观察是否出现特征现象



