题目内容
17. 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别为 I1=738,I2=1451,I3=7733,I4=10540(单位:kJ/mol) |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
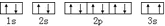 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于第ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形.
(6)F元素的晶胞如图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M g/mol,则F原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$ cm.
分析 A、B、C、D、E为短周期主族元素,原子序数依次增大,元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H;B元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即B为N;由C原子的第一至第四电离能,则C为Mg;D原子核外所有p轨道全满或半满,则价电子为3s23p3符号题意,即D为P;E元素的主族序数与周期数的差为4,E为第三周期第ⅥⅠA族元素,即E为Cl;F、G为第四周期元素,它们的原子序数依次增大,F是前四周期中电负性最小的元素,则F为K,G在周期表的第七列,则G为Mn,然后利用原子结构及分子的空间构型来解答.
解答 解:A、B、C、D、E为短周期主族元素,原子序数依次增大,元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H;B元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即B为N;由C原子的第一至第四电离能,则C为Mg;D原子核外所有p轨道全满或半满,则价电子为3s23p3符号题意,即D为P;E元素的主族序数与周期数的差为4,E为第三周期第ⅥⅠA族元素,即E为Cl;F、G为第四周期元素,它们的原子序数依次增大,F是前四周期中电负性最小的元素,则F为K,G在周期表的第七列,则G为Mn,
(1)水电离的实质是分子结合另一分子的氢离子形成阳离子,另一分子形成阴离子发生电离,故液氨中的电离平衡方程式为:为2NH3?NH4++NH2-,
故答案为:2NH3?NH4++NH2-;
BA5为离子化合物,则为NH4H,其电子式为 ,故答案为:
,故答案为: ;
;
(2)B为N,能量最高的电子为2p电子,其电子云在空间有3个方向,p轨道为纺锤形,
故答案为:3;纺锤形;
(3)由泡利原理可知,电子在同一轨道内的自旋方向应相反,C基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利原理,
故答案为:泡利原理;
(4)G为Mn,在第四周期第ⅦB,最后填充的为d电子,在d区,其价电子为3d54s2,
故答案为:第ⅦB;d;3d54s2;
(5)PCl3中,孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,
故答案为:sp3;三角锥形;
(6)K元素的晶胞如图所示,该晶胞中K原子个数=1+8×$\frac{1}{8}$=2,晶胞的质量为:$\frac{2M}{{N}_{A}}$g,若设该晶胞的密度为ag/cm3,则晶胞的体积=$\frac{\frac{2M}{{N}_{A}}g}{ag•c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,则晶胞的棱长=$\root{3}{\frac{2M}{a{N}_{A}}}$cm,设F原子的半径为r cm,晶胞体对角线上的3个F原子相邻,则:(4r)2=3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2,r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$.
点评 本题考查位置、结构、性质的综合应用,题目难度较大,推断各元素名称为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握原子结构还与元素周期律、元素周期表的关系.

 灵星计算小达人系列答案
灵星计算小达人系列答案| A. | 按系统命名法,有机物 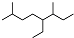 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的  最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |
 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
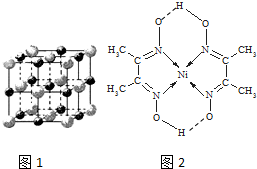
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键
(5)为消除温室效应的影响,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
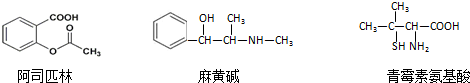
| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有8种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH溶液反应 |
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |
(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
 或
或 或
或 ;
; .
.