题目内容
17.下列大小顺序排列不正确的组合是( )| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>KI>K |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,K的熔沸点较低.
解答 解:A.根据元素周期律,非金属性:O>S>Si,所以气态氢化物的稳定性:H2O>H2S>SiH4,故A正确;
B.Cl-比 O2-与Mg2+的电子层数多一层,所以氯离子的半径最大,O2-与Mg2+的电子层结构相同,核电荷数少的半径大,所以O2->Mg2+,故B正确;
C.根据元素周期律,非金属性:P<S<Cl,所以最高价氧化物的水化物的酸性:H3PO4<H2SO4<HClO4,故C错误;
D.KCl、KI是离子晶体,熔点随离子半径的增大而降低,氯离子的半径小于碘离子半径,所以熔点:KCl>KI,而K是金属晶体,熔点较低,所以熔点:KCl>KI>K,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期元素原子结构和性质递变规律特点是解本题关键,注意离子晶体熔沸点比较方法,金属晶体熔沸点差别较大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
8.在镀锌铁皮的锌镀层厚度的测定过程中,下列操作会导致测定结果偏高的是( )
| A. | 过早判断反应终点 | |
| B. | 在测定铁皮的面积时测得面积比铁皮的实际面积大 | |
| C. | 过迟判断反应终点 | |
| D. | 锌在酸中溶解后,铁皮未烘干就去称重 |
5.下列各组物质中,从物质分类的角度看,后者从属于前者的是( )
| A. | 纯净物、混合物 | B. | 金属、非金属 | C. | 纯净物、化合物 | D. | 含氧酸、无氧酸 |
12.现有反应S2Cl2(l)(橙黄色)+Cl2(g)?2SCl2(l)(鲜红色)△H=-50.16kJ•mol-1.在密闭容器中达到平衡,下列说法错误的是( )
| A. | 温度不变,增大容器的体积,S2Cl2的转化率降低 | |
| B. | 温度不变,缩小容器体积,液体的颜色加深 | |
| C. | 压强不变,升高温度,液体的颜色变浅 | |
| D. | 体积不变,降低温度,氯气的转化率降低 |
2.下列说法正确的是( )
| A. | 杂化轨道可以参与π键的形成 | |
| B. | 杂化前后的轨道数不变,但轨道的形状发生了改变 | |
| C. | 共价键都有方向性 | |
| D. | 基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、6种电子运动状态 |
9.下列实验能达到目的是( )
| 序号 | 实验目的 | 实验操作 |
| A | 证明Ksp(AgI)<Ksp(AgCl) | 在AgNO3溶液中滴加少量NaCl溶液,产生白色沉淀,继续滴加少量KI溶液又产生黄色沉淀 |
| B | 阿司匹林的提纯,即除去混有的水杨酸聚合物等杂质 | 将阿司匹林粗品溶解在适量饱和碳酸氢钠溶液中,抽滤后在滤液中加入盐酸,再抽滤并洗涤 |
| C | 检验火柴头中含氯元素 | 往浸过火柴头的溶液中加AgNO3溶液和稀硝酸 |
| D | 加快锌与稀硫酸反应制取H2的速率 | 在稀硫酸中滴加少量Cu(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述正确的是( )
| A. | 该晶体的熔沸点低、硬度小 | |
| B. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| C. | 晶体的空间最小环共有6个原子构成 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
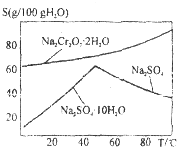 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下: