题目内容
3.常温下,下列液体pH>7的是( )| A. | 正常的人体血液 | B. | 食盐溶液 | C. | 橙汁 | D. | 胃液 |
分析 常温下,pH>7的溶液呈碱性,pH=7的溶液呈中性,pH<7的溶液呈酸性,据此分析解答.
解答 解:A.正常的人体血液pH在7.35-7.45之间,所以溶液呈碱性,故A正确;
B.氯化钠是强碱强酸盐,其水溶液呈中性,pH=7,故B错误;
C.橙汁中含有柠檬酸,其溶液呈酸性,pH<7,故C错误;
D.胃液的主要成分是HCl,胃液呈酸性,pH<7,故D错误;
故选A.
点评 本题考查溶液酸碱性判断,明确物质中成分及其性质是解本题关键,注意:只有温度确定时才能根据pH大小判断溶液酸碱性,如果温度未知,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,为易错点.

练习册系列答案
相关题目
14.体积为V mL,密度为ρ g/mL的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度为c mol/L,溶质的质量分数为w%,则下列表示正确的是( )
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
18.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 裂解 | ||
| C. | 从煤焦油中得到苯、甲苯、二甲苯等 | D. | 古代植物变质成煤 |
8.在镀锌铁皮的锌镀层厚度的测定过程中,下列操作会导致测定结果偏高的是( )
| A. | 过早判断反应终点 | |
| B. | 在测定铁皮的面积时测得面积比铁皮的实际面积大 | |
| C. | 过迟判断反应终点 | |
| D. | 锌在酸中溶解后,铁皮未烘干就去称重 |
12.现有反应S2Cl2(l)(橙黄色)+Cl2(g)?2SCl2(l)(鲜红色)△H=-50.16kJ•mol-1.在密闭容器中达到平衡,下列说法错误的是( )
| A. | 温度不变,增大容器的体积,S2Cl2的转化率降低 | |
| B. | 温度不变,缩小容器体积,液体的颜色加深 | |
| C. | 压强不变,升高温度,液体的颜色变浅 | |
| D. | 体积不变,降低温度,氯气的转化率降低 |
13.200mL 0.3mol/L Na2SO4溶液和100mL 0.2mol/L Al2(SO4)3的溶液混合后,加水稀释至500mL.稀释后溶液中SO42-的物质的量的浓度为( )
| A. | 0.4mol/L | B. | 0.24mol/L | C. | 0.35mol/L | D. | 0.5mol/L |
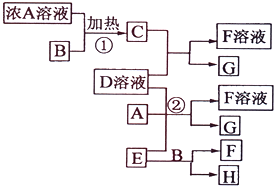 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.