题目内容
【题目】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:____。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式:____。
Ⅱ.(3)尿素(H2NCONH2)水解生成H2NCOONH4(氨基甲酸铵,简称甲铵),甲铵不稳定,迅速分解生成两种气态化合物,溶于水后,一个呈酸性,一个呈碱性,请写出甲铵受热分解的化学方程式:____。
(4)甲铵在不同条件下分解的能量变化如图所示,N过程与M过程相比,N过程活化能大大降低的原因可能是____;ΔH=___kJ·mol1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
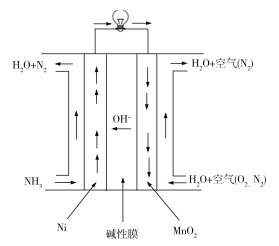
(5)MnO2电极为__极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:____。
【答案】[:H]Mg2+[:H] MgH2+2NH3=Mg(NH2)2+2H2 H2NCOONH4![]() 2NH3↑+CO2↑ 加入了催化剂,催化剂能大大降低反应的活化能 +(b-c) 正 2NH3-6e+6OH=N2+6H2O
2NH3↑+CO2↑ 加入了催化剂,催化剂能大大降低反应的活化能 +(b-c) 正 2NH3-6e+6OH=N2+6H2O
【解析】
(1)MgH2是离子化合物,Mg失去两个电子给两个氢,所以Mg显+2价,H显-1价,其电子式为[:H]Mg2+[:H]。
(2)根据MgH2与H2O反应的机理是MgH2中-1价的氢与H2O中+1价的氢(![]() -OH)发生氧化还原反应(归中反应)生成氢气,MgH2与NH3反应同MgH2与H2O反应,即NH3拆成
-OH)发生氧化还原反应(归中反应)生成氢气,MgH2与NH3反应同MgH2与H2O反应,即NH3拆成![]() -NH2,反应机理相同,即方程式为MgH2+2NH3=Mg(NH2)2+2H2。
-NH2,反应机理相同,即方程式为MgH2+2NH3=Mg(NH2)2+2H2。
(3)甲铵不稳定,根据甲铵的结构式和分解生成两种气态化合物,溶于水后,一个呈酸性(H2CO3),一个呈碱性(NH3·H2O),可知气体是NH3、CO2,反应方程式为H2NCOONH4![]() 2NH3↑+CO2↑。
2NH3↑+CO2↑。
(4)N过程与M过程相比大大降低反应的活化能,在相同的条件下,只有加入催化剂,才能大大降低反应的活化能。根据分解的能量变化图可知反应物能量为c kJ·mol-1,生成物能量为bkJ·mol-1,为吸热反应,故ΔH=+(b-c) kJ·mol-1。
(5)根据两极进出口物质化合价的判断,MnO2电极是O2得到电子和H2O反应生成OH,得电子的极为正极,Ni电极是NH3失电子结合电解质溶液中的OH生成N2和H2O,故Ni电极的电极反应式为2NH3-6e+6OH=N2+6H2O。

【题目】下列实验图示不能完成实验描述的是
选项 | 实验描述 | 实验图示 |
A | 该实验能验证氧化性: H2O2>Br2>H2SO3 |
|
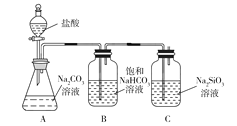
B | 该实验能够实现比较HCl、H2CO3、H2SiO3酸性的强弱 |
|
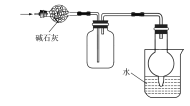
C | 该实验装置用于干燥、收集并吸收多余氨气 |
|
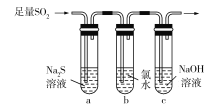
D | 该实验能验证SO2的氧化性、还原性 |
|
A. AB. BC. CD. D