题目内容
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19gcm-3HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
a.溶液的浓度
b.溶液中HCl的质量
c.溶液中Cl-的数目
d.溶质的质量分数
(3)某学生欲用上述浓盐酸和蒸馏水配制40mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取_______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?______(填“偏大”、“偏小”、“无影响”)
a.用量筒量取浓盐酸时仰视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.8gNaOH的溶液,则该同学需取_______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.8g NaOH的溶液,发现比①中所求体积偏小则可能的原因是_______。
a.加水时超过刻度线,用胶头滴管吸出
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.配置溶液时,量取浓盐酸后用蒸馏水洗涤量筒并转移至烧杯中
【答案】11.9 ad 1.7 偏大;偏小 50 cd
【解析】
(1)![]() ;
;
(2)根据溶液的性质分析;
(3)①配制40mL物质的量浓度为0.400mol/L的稀盐酸,需用50mL容量瓶;根据稀释前后氯化氢的物质的量不变计算需浓盐酸的体积;
②根据![]() 分析误差;
分析误差;
(4)①根据n(HCl)=n(NaOH)计算盐酸的体积;
②假设该同学用新配制的盐酸中和含0.8gNaOH的溶液,发现比①中所求体积偏小,说明盐酸的浓度偏大。
(1)![]() ;
;
(2)a.溶液的浓度是溶液本身的性质,不随所取体积的多少而变化,故选a;
b.溶液中HCl的质量=溶液质量×溶质的质量分数,所以溶液中HCl的质量随所取体积的多少而变化,故不选b;
c. 溶液中HCl的物质的量=溶液的体积×物质的量浓度,所以溶液中Cl-的数目随所取体积的多少而变化,故不选c;
d.溶质的质量分数是溶液本身的性质,不随所取体积的多少而变化,故选d;
答案选ad。
3)(3)配制40mL物质的量浓度为0.400mol/L的稀盐酸,需用50mL容量瓶;设需浓盐酸的体积为VmL;50mL×0.400mol/L=VmL×11.9mol/L,V≈1.7mL;
②a.用量筒量取浓盐酸时仰视观察凹液面,浓盐酸体积偏大,所配制的稀盐酸的物质的量浓度偏大;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,溶液的体积偏大,所配制的稀盐酸的物质的量浓度偏小;
(4)①设需盐酸的体积为VmL;n(HCl)=n(NaOH),![]() V×10-3L×0.400mol/L,解得V=50 mL。
V×10-3L×0.400mol/L,解得V=50 mL。
②假设该同学用新配制的盐酸中和含0.8g NaOH的溶液,发现比①中所求体积偏小,说明盐酸的浓度偏大;
a.加水时超过刻度线,用胶头滴管吸出,溶质偏少,所配溶液浓度偏小,故不选a;
b.配制溶液时,未洗涤烧杯,溶质偏少,所配溶液浓度偏小,故不选b;
c.配制溶液时,俯视容量瓶刻度线,溶液体积偏小,所配溶液浓度偏大,故选c;
d.配制溶液时,量取浓盐酸后用蒸馏水洗涤量筒并转移至烧杯中,溶质偏多,所配溶液浓度偏大,故选d;
答案选cd。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ______
(2)该反应为 ______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 ______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为 ______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol-1
反应②2CO(g)+O2(g)2CO2(g)△H2=b kJmol-1
反应③2Fe(s)+O2(g)2FeO(s)△H3
则△H3= ______ (用含a、b的代数式表示).
【题目】下表是不同温度下水的离子积常数,试回答以下问题:
温度(℃) | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α______(填“<”“>”或“=”)1×10-14。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=________。
(3)25℃下,将pH=1的盐酸溶液和pH=5的盐酸溶液等体积混合,则混合液中水电离出的c(OH-)=________。
(4)将t2℃温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸溶液bL混合,所得混合溶液pH=2,则a:b=______;此溶液中离子浓度的由大到小的排列顺序是______________________________。(以上均忽略溶液混合前后体积的变化)
(5)将t2℃温度下pH=9的苛性钠溶液与pH=y的稀醋酸溶液等体积混合,所得混合溶液显中性,则y____3(填“大于”“小于”或“等于”);此溶液中微粒浓度的由大到小的排列顺序是________________________。(以上均忽略溶液混合前后体积的变化)
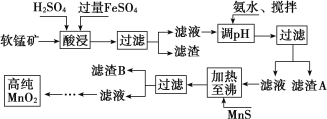
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。