题目内容
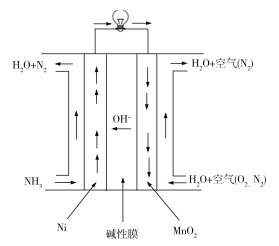
【题目】下面a~f是中学化学实验中常见的几种仪器:
a 量筒 b 容量瓶 c 托盘天平 d 温度计 e 分液漏斗
(1)标出仪器使用温度的是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________ g。
(4)在某次实验中,要用500mL 0.52mol·L-1的NaOH溶液, 配制此浓度NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、_________和___________;
(5)下列操作使所配物质的量浓度偏大的有__________(填写字母)。
A 称量时用了生锈的砝码;
B 将NaOH放在托盘天平的右盘上称量(使用游码);
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D 往容量瓶转移时,有少量液体溅出;
E 定容时俯视刻度线;
F 容量瓶未干燥即用来配制溶液;
G 定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(6) 实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制240mL0.1mol ·L-1的盐酸.
请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240mL 0.1mol·L-1的盐酸应量取浓盐酸体积______mL,应选用容量瓶的规格是______mL.
【答案】ab be 9.5 500ml容量瓶 胶头滴管 ACE 12.5mol/L 2.0 250
【解析】
(1)标出仪器使用温度的是容量瓶和温度计,配溶液时需指明温度,因为配置溶液需在一定温度下进行,温度改变会影响浓度,温度计是测量物质的温度的仪器,须标明温度的量程和刻度值,
故答案为:ab;
(2)使用前需要检查是否漏水的是容量瓶,分液漏斗,它们都是需密封使用的容器,所以需要检查是否漏水。
故答案为:be;
(3)称取10.5 g固体样品,则砝码为10克,游码为0.5克,天平的设计是左盘的质量等于右盘加游码的质量,如放反,则物品的质量等于游码加砝码的质量,则物品的质量为10-0.5=9.5克
故答案为:9.5;
(4)配制500mL 0.52mol·L-1的NaOH溶液,需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、500ml容量瓶和胶头滴管。
故答案为:500ml容量瓶;胶头滴管;
(5) A 称量时用了生锈的砝码;砝码生锈后质量偏大,导致所配溶液物质的量偏高,所配物质的量浓度偏大,A符合题意;
B 将NaOH放在托盘天平的右盘上称量(使用游码);导致所配溶液物质的量偏低,所配物质的量浓度偏小,B不符合题意;
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;待溶液冷却至室温,溶液体积减小,则溶液的浓度偏大,C符合题意;
D 往容量瓶转移时,有少量液体溅出,导致所配溶液物质的量偏低,所配物质的量浓度偏小,D不符合题意;
E 定容时俯视刻度线;定容时俯视容量瓶刻度线,导致溶液总体积偏小,溶液的浓度偏大,E符合题意;
F 容量瓶未干燥即用来配制溶液;容量瓶内残留一定量蒸馏水,不影响溶液配制,溶液的浓度不变,故F不符合题意;
G 定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液总体积偏大,溶液的浓度偏小,G不符合题意;
故答案为:ACE;
(6) 实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制240mL 0.1mol ·L-1的盐酸.
c(HCl)![]() =12.5 mol ·L-1
=12.5 mol ·L-1
故答案为:12.5mol/ L
配制240mL 0.1mol·L-1的盐酸应选用250 mL容量瓶,量取浓盐酸的浓度为12.5 mol/ L,设需要12.5 mol/ L的盐酸的体积为VL,则根据溶液稀释公式可得,0.25L ×0.1mol·L-1=12.5 mol/ L×VL需该浓度盐酸体积V=![]() =0.002L=2 mL
=0.002L=2 mL
故答案为:2.0;250。

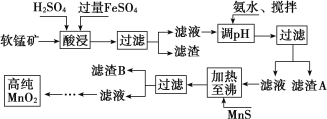
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。