题目内容
【题目】25°C向![]() 中滴加
中滴加![]() 过程中,
过程中,![]() 变化如图所示。
变化如图所示。
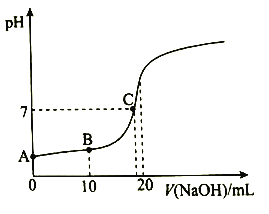
(1)A点溶液![]() ,用化学用语解释原因:_________________。
,用化学用语解释原因:_________________。
(2)下列有关B点溶液的说法正确的是_______________(填字母序号)。
a. 溶质为:![]()
b. 微粒浓度满足:![]()
c. 微粒浓度满足:![]()
(3)![]() 两点水的电离程度:
两点水的电离程度:![]() ______
______![]() (填“
(填“![]() ”、“
”、“ ![]() ”或“
”或“![]() ”)。
”)。
【答案】![]() ab
ab ![]()
【解析】
(1)![]() 是弱电解质,用化学用语解释溶液
是弱电解质,用化学用语解释溶液![]() 即写出
即写出![]() 电离的方程式;
电离的方程式;
(2)B点加入的![]() 的物质的量为
的物质的量为![]() 的一半,故溶质为
的一半,故溶质为![]() 和
和![]() ,且物质的量之比为1:1;
,且物质的量之比为1:1;
(3)酸和碱会抑制水的电离,大部分能水解的盐促进水的电离;
(1)![]() 是弱电解质,在溶液中部分电离,导致氢离子浓度小于
是弱电解质,在溶液中部分电离,导致氢离子浓度小于![]() ,溶液
,溶液![]() 。其电离的方程式为:
。其电离的方程式为:![]() ;
;
(2)B点溶液:
a. ![]() 和
和![]() 物质的量之比为1:1,故a正确;
物质的量之比为1:1,故a正确;
b.由电荷守恒可知,溶液中存在:![]() ,故b正确;
,故b正确;
c. 由物料守恒(原子守恒)可知,溶液中存在:![]() ,故c错误;
,故c错误;
(3)酸和碱会抑制水的电离,大部分能水解的盐促进水的电离,A点的酸性溶液抑制水的电离,C点为醋酸和醋酸钠的混合溶液,因为PH=7,醋酸的抑制作用与醋酸钠的促进作用相互抵消,对水的电离无影响,故水的电离程度:A<C;

【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
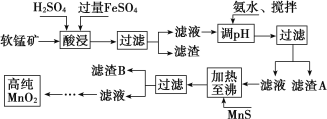
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)

①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________
【题目】将甘油![]() 转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得
转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得![]() ,反应过程如下:
,反应过程如下:
反应Ⅰ |
| 甘油水蒸气重整 |
反应Ⅱ |
| 甘油部分氧化 |
反应Ⅲ |
| 甘油氧化水蒸气重整 |
下列说法正确的是( )
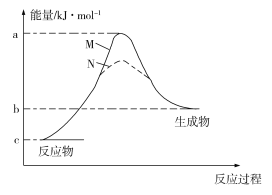
A. ![]() B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
C. 消耗等量的甘油,反应的产氢率最高D. 甘油不溶于水