题目内容
15.根据如图所示实验回答下列问题: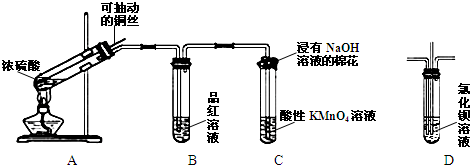
(1)装置A中试管内发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)根据装置B中的现象可以证明SO2具有漂白性,反应一段时间后,将装置B中试管加热,可以观察到溶液由无色变成红色.
(3)装置C中试管口的棉花团上发生反应的离子方程式为SO2+OH-=SO32-+H2O.
(4)如果将装置B换成装置D,并从直立导管中向氯化钡溶液中通入另一种气体,产生白色沉淀,则这种气体可能是NO2(或Cl2、O2、NH3)(填一种即可).
分析 (1)铜和浓硫酸加热条件下发生氧化还原反应生成硫酸铜和二氧化硫气体;二氧化硫有毒,需要用浸有氢氧化钠溶液的棉团吸收;
(2)二氧化硫具有漂白性,可使品红褪色;二氧化硫的漂白性是暂时的,加热后会恢复原色;
(3)二氧化硫与强氧化钠溶液反应生成亚硫酸钠和水;
(4)二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸分析.
解答 解:(1)加热条件下,铜和浓硫酸发生氧化还原反应生成硫酸铜和二氧化硫气体,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)二氧化硫通过盛品红的B试管,品红溶液会褪色,证明二氧化硫具有漂白性;二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色,
故答案为:漂白;溶液由无色变成红色;
(3)二氧化氮有毒,需要用强氧化钠溶液吸收,反应的离子方程式为:SO2+OH-=SO32-+H2O,
故答案为:SO2+OH-=SO32-+H2O;
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如:NO2、Cl2、O2等,
故答案为:NO2(或Cl2、O2、NH3).
点评 本题考查浓硫酸的性质,题目难度中等,注意掌握铜与浓硫酸的反应原理,明确二氧化硫的性质及检验方法,试题培养了学生的分析能力及灵活应用能力.

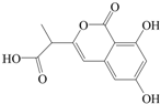
| A. | 该有机物的分子式为C12H12O6 | |
| B. | 该有机物的分子中只含有1个手性碳原子 | |
| C. | 可用FeCl3溶液检验该有机物质中是否含有苯酚 | |
| D. | 1mol该有机物最多可以和4molNaOH反应 |
| A. | 3-甲基己烷 | B. | 4-乙基戊烷 | C. | 2-乙基戊烷 | D. | 2,2-二甲基戊烷 |
| A. | 硅、硫、氯 | B. | 锂、钠、钾 | C. | 氟、氯、溴 | D. | 碳、氧、铝 |
| A. | 减小压强 | B. | 缩小体积 | C. | 降低温度 | D. | 增大氢气的浓度 |
| A. | 称取3g左右的干海带-托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物-漏斗 | |
| C. | 灼烧干海带至完全变成灰烬-蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘-分液漏斗 |
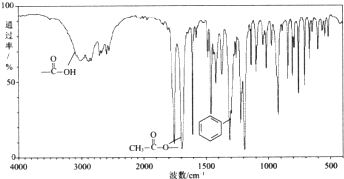
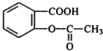 ,X在一定条件下能发生的反应是acd(选填字母);
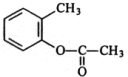
,X在一定条件下能发生的反应是acd(选填字母);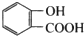 )能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是
)能与化合物Y在一定条件发生取代反应生成X与乙酸,该反应的化学方程式是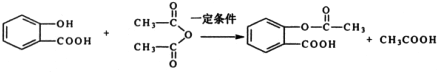 ;
; ②苯环上的一溴代物只有两种
②苯环上的一溴代物只有两种 :
: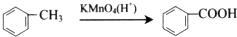
 .
.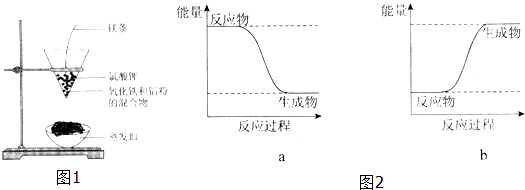
 Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.