题目内容
7.化学反应中伴随着能量变化.(1)下列反应中,属于吸热反应的是b(填序号).
a.燃烧CO b.Ba(OH)2•8H2O晶体和NH4l晶体反应
c.铝和稀盐酸反应 d.NaOH溶液和稀盐酸反应
(2)按图1所示装置进行实验.
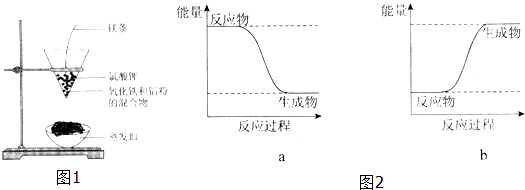
【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出.
由此判断该反应是放热(填“吸热”或“放热”)反应,其反应的化学方程式是Fe2O3+2Al
 Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,反应物总能量大于生成物总能量.
解答 解:(1)a.燃烧CO是放热反应,故错误;
b.氯化铵晶体与氢氧化钡晶体反应是吸热反应,故正确;
c.铝和稀盐酸的反应是放热反应,故错误;
d.NaOH溶液和稀盐酸反应是放热反应,故错误.
故选b;
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,方程式为:Fe2O3+2Al  Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示,故答案为:放热;Fe2O3+2Al
Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示,故答案为:放热;Fe2O3+2Al  Al2O3+2 Fe; a.
Al2O3+2 Fe; a.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
2.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 金属元素和非金属元素分界线附近的元素 | |
| B. | 右上方区域的非金属元素 | |
| C. | 过渡元素 | |
| D. | 稀有气体元素 |
12.下列各组离子在溶液中能大量共存的是( )
| A. | Na+、H+、Cu2+、NO3- | B. | Na+、Fe2+、H+、NO3- | ||
| C. | NH4+、Cl-、SO42-、OH- | D. | HCO3-、Mg2+、Na+、OH- |
19.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| D. | 1mol金刚石含4NAC-C键 |
17.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=12溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |