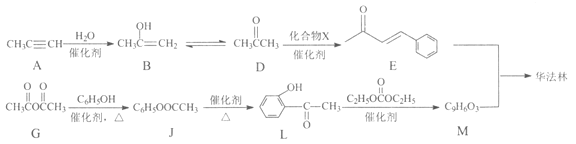
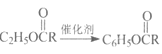
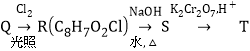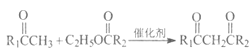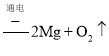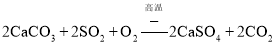题目内容
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:

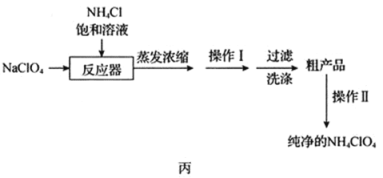
(1)反应器中发生反应的基本反应类型是_____。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为_____。
(3)洗涤粗产品时,宜用_____(填“0℃冷水”或“80°C热水”)洗涤。
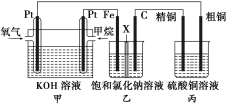
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、O2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
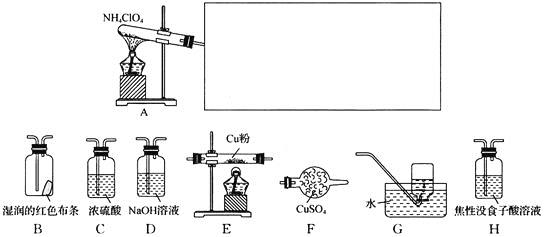
①写出高氯酸铵分解的化学方程式_____。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→_____(填装置对应的字母),证明氧气存在的实验现象为_____。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为_____。
【答案】复分解反应 重结晶 0℃冷水 ![]() N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G E中玻璃管内固体逐渐变成黑色
N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G E中玻璃管内固体逐渐变成黑色 ![]()
【解析】
NaClO4溶液和NH4Cl饱和溶液混合,常温下NH4ClO4的溶解度最小,可析出NH4ClO4固体,从而制得NH4ClO4固体,实际发生复分解反应,再经过蒸发浓缩、冷却结晶、过滤等操作得到NH4ClO4粗品,将NH4ClO4重结晶可得纯净的NH4ClO4;
NH4ClO4在A中分解,无水硫酸铜检验水,若无水硫酸铜变蓝,则产物有水;
再用湿润的红色布条检验Cl2,若布条褪色,则产物有Cl2;
接下来用NaOH溶液将Cl2除去,用浓硫酸将除Cl2时带上的水蒸气除去;
将气体通入放有Cu和加热的硬质玻璃管检验氧气,若产物含氧气,玻璃管内红色固体逐渐变黑;
接下来用焦性没食子酸溶液将O2吸收,然后将气体通入G,若产物有氮气,将收集到一瓶氮气,据此分析解答。
(1)由上面的分析可知,反应器中发生的反应为:![]() ,为复分解反应,故答案为:复分解反应;
,为复分解反应,故答案为:复分解反应;
(2)将粗产品进行重结晶可得到纯净的NH4ClO4,故答案为:重结晶;
(3)根据图2可知,NH4ClO4的溶解度随温度的升高而增大,0℃时溶解度低于NH4Cl和NaCl,且NH4Cl和NaCl在0℃时依然有较高的溶解度,则在洗涤粗产品时,宜用0℃冷水,故答案为:0℃冷水;
(4)①已知NH4ClO4在![]() 时开始分解为
时开始分解为![]() 、
、![]() 、
、![]() 、
、![]() ,可得高氯酸铵分解的化学方程式:
,可得高氯酸铵分解的化学方程式:![]() ,注意400℃时,水为气体,故答案为:
,注意400℃时,水为气体,故答案为:![]() ;
;
②从上面的分析可知,先用无水硫酸铜检验水蒸汽,用湿润的红色布条检验氯气,再用NaOH溶液吸收氯气,用浓硫酸吸收前面带上的水蒸气,用灼热的Cu粉检验氧气,用焦性没食子酸溶液吸收氧气,用排水法收集氮气。注意:水蒸气必须在最开始检验,氧气与铜反应前必须除去氯气,故装置的连接顺序为:A→F→B→D→C→E→H→G,若产物含氧气,则红色的Cu粉会变成黑色的Cu,故答案为:F→B→D→C→E→H→G;E中玻璃管内固体逐渐变成黑色;
③若将Cu换成Mg,则E装置中N2与Mg反应生成Mg3N2,能使湿润的红色石蕊试纸变蓝色的气体为氨气,结合原子守恒可知,滴加蒸馏水发生反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() 。
。

 走进文言文系列答案
走进文言文系列答案