题目内容
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见下图)。
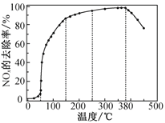
反应相同时间NOx的去除率随反应温度的变化曲线如题下图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
【答案】 136.2 HNO22e+H2O![]() 3H++NO3 2HNO2+(NH2)2CO
3H++NO3 2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O 迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 催化剂活性下降;NH3与O2反应生成了NO
2N2↑+CO2↑+3H2O 迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 催化剂活性下降;NH3与O2反应生成了NO
【解析】(1)将两个方程式编号,应用盖斯定律,解总焓变;
(2)根据电解原理,阳极发生失电子的氧化反应;
(3)HNO2与(NH2)2CO反应生成N2和CO2,根据电子守恒和原子守恒配平;
(4)因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应。
(1)将两个方程式编号,
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1(①式)
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1(①式)
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1 (②式)
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1 (②式)
应用盖斯定律,将(①×3+②)![]() 2得,反应3NO2(g)+H2O(l)
2得,反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=[(-116.1 kJ·mol1)×3+75.9 kJ·mol1]
2HNO3(aq)+NO(g)的ΔH=[(-116.1 kJ·mol1)×3+75.9 kJ·mol1]![]() 2=-136.2kJ·mol1,
2=-136.2kJ·mol1,
故答案为:136.2;
(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失电子生成HNO3,1mol HNO2反应失去2mol电子,结合原子守恒和溶液呈酸性,电解时阳极的电极反应式为:HNO22e+H2O![]() 3H++NO3,
3H++NO3,
故答案为:HNO22e+H2O![]() 3H++NO3;
3H++NO3;
(3)HNO2与(NH2)2CO反应生成N2和CO2,N元素化合价由HNO2中+3价降至0价,N元素的化合价由(NH2)2CO中-3价升至0价,根据得失电子守恒和原子守恒,反应的化学方程式为:2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O,
2N2↑+CO2↑+3H2O,
故答案为:2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O;
2N2↑+CO2↑+3H2O;
(4)因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应,在50~250 ℃范围内,NOx的去除率先迅速上升是催化剂活性随着温度升高增大,与温度升高共同使NOx的去除率迅速增大;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是温度升高催化剂活性下降,NH3与O2反应生成了NO,
故答案为:迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 ;催化剂活性下降;NH

 春雨教育同步作文系列答案
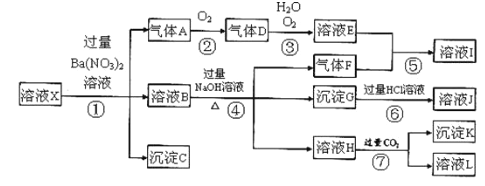
春雨教育同步作文系列答案【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
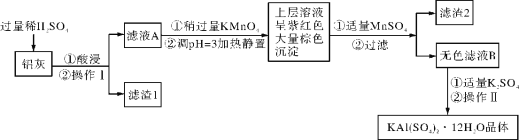
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。