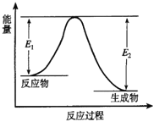
题目内容
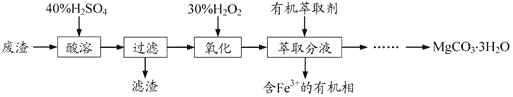
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
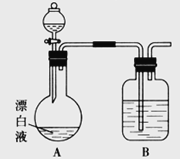
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
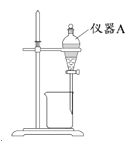
①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快反应(酸溶)速率;避免制备MgCO3时消耗更多的碱或影响Mg2+转化成MgCO3
(2)H2O2+2Fe2++2H+===2Fe3++2H2O
(3)①分液漏斗 ②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止
【解析】试题分析:(1)加热可以加快化学反应速率;如果硫酸过多,则需要消耗更多的减中和硫酸,从而造成生产成本增加。(或影响Mg2+转化成MgCO3。)
(2)滤液中含有Fe2+,加入H2O2将Fe2+氧化为Fe3+,发生发应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①根据仪器A的构造确定其名称为分液漏斗。②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,充分振荡、静置、分液,并重复多次。
(4)根据题给信息知向溶液中加入氨水调节pH不大于8.5,不小于5.0,故由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案