题目内容
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
【答案】 Fe3++3H2O![]() Fe(OH)3(胶体)+ 3H+ 除去草酸根离子,避免干扰步骤3中Fe2+的滴定 将Fe3+还原为Fe2+ 加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去 ABC 20.0%
Fe(OH)3(胶体)+ 3H+ 除去草酸根离子,避免干扰步骤3中Fe2+的滴定 将Fe3+还原为Fe2+ 加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去 ABC 20.0%
【解析】(1)草酸铁溶液中铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用;
(2) 步骤2中用KMnO4将草酸氧化生成二氧化碳,除去草酸根离子,避免干扰步骤3中Fe2+的滴定;
(3)加入锌粉的目的是还原铁离子;
(4)高锰酸钾溶液为紫红色,滴入最后一滴溶液变为紫红色且半分钟不变说明反应达到终点;
(5)根据滴定误差分析的方法判断,误差可以归结为标准液的体积消耗变化分析误差,c(待测)=![]() ;
;
A.酸式滴定管要用标准液润洗;
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失,读取标准溶液体积增大;
C.读取标准液体积时,滴定前平视读数,滴定后仰视读数,读取标准溶液体积增大;
D. 锥形瓶在滴定时剧烈摇动,有少量液体溅出,反应消耗的标准溶液体积减小;
(6)根据离子方程式计算,n(Fe)=5n(MnO4-),可以计算n(Fe),然后可以计算晶体中铁的含量。
(1)草酸铁溶液中铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+ 3H+,
Fe(OH)3(胶体)+ 3H+,
因此,本题正确答案是:Fe3++3H2O![]() Fe(OH)3(胶体)+ 3H+;
Fe(OH)3(胶体)+ 3H+;
(2) 步骤2中用KMnO4将草酸氧化生成二氧化碳,除去草酸根离子,避免干扰步骤3中Fe2+的滴定,
因此,本题正确答案是:除去草酸根离子,避免干扰步骤3中Fe2+的滴定;
(3)加入锌粉的目的是将Fe3+还原为Fe2+,
因此,本题正确答案是:将Fe3+还原为Fe2+;
(4)高锰酸钾溶液为紫红色,反应终点判断为:加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去,
因此,本题正确答案是:加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去;
(5)A.酸式滴定管要用标准液润洗,滴定管用蒸馏水洗涤后,立即装入标准液,标准液浓度减小,消耗标准液体积增大,测定结果偏高,故A符合;
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失,读取标准溶液体积增大,测定结果偏高,故B符合;
C.读取标准液体积时,滴定前平视读数,滴定后仰视读数,读取标准溶液体积增大,测定结果偏高,故C符合;
D. 锥形瓶在滴定时剧烈摇动,有少量液体溅出,反应消耗的标准溶液体积减小,测定结果偏低,故D不符合;
因此,本题正确答案是:ABC;
(6)用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL,计算平均值,实验3数值误差较大舍去,消耗体积V=![]() mL =20.00mL,
mL =20.00mL,
铁元素守恒,高锰酸钾溶液滴定亚铁离子发生的反应为:
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n 0.0200mol/L×0.0200L=0.0004mol![]() ,解得n=0.002mol,
,解得n=0.002mol,
250 mL溶液中含铁元素物质的量=0.002mol×![]() =0.02mol,
=0.02mol,
5.6g草酸铁晶体中铁的含量=![]() 100%=20.0%,
100%=20.0%,
因此,本题正确答案是: 20.0%。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.几种金属离子沉淀的pH:
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)加入过量硫酸之前先要将铬铁矿矿石粉碎,其目的是________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式_____________。
写出该反应的离子方程式_____________。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
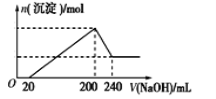
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含铁化合物的物质的量为___________。
【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)