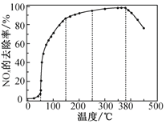
题目内容
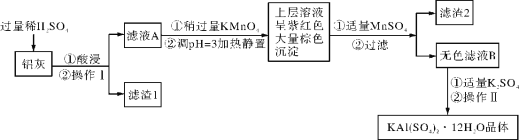
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O===5MnO2↓+4H+ MnO2、Fe(OH)3
Al(OH)3(胶体)+3H+ 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O===5MnO2↓+4H+ MnO2、Fe(OH)3
【解析】
铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液pH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝钾晶体;
(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用;
(2)检验亚铁离子用高锰酸钾溶液或铁氰化钾溶液;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子;
(4)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应结合原则守恒和电荷守恒配平书写离子方程式;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀。
铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液pH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝钾晶体;(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用,反应的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(2)检验亚铁离子用高锰酸钾溶液或 铁氰化钾溶液,滴入高锰酸钾溶液紫红色褪去,或加入铁氰化钾溶液会呈现蓝色溶液;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O= 2NaAlO2+3H2↑;酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O;
(4)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应,反应的离子方程式为:3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀;故答案为:MnO2、Fe(OH)3。

【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)