题目内容
 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+2H2O
Cl2+2OH-=Cl-+ClO-+2H2O
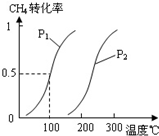
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
N2H4+4OH-=N2↑+4H2O+4e-
N2H4+4OH-=N2↑+4H2O+4e-
.②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
.或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
分析:(1)根据M=ρVm来计算分子的相对分子质量;
(2)①用H2表示的平均反应速率可以根据甲烷的反应速率来求算,根据v=
来计算甲烷的反应速率;
②根据压强对化学平衡移动的影响来回答;
③根据温度对化学反应速率的影响来回答;
(3)①在燃料电池中,负极发生失电子的氧化反应;
②根据盖斯定律来计算化学反应的焓变.
(2)①用H2表示的平均反应速率可以根据甲烷的反应速率来求算,根据v=
| △c |
| △t |
②根据压强对化学平衡移动的影响来回答;
③根据温度对化学反应速率的影响来回答;
(3)①在燃料电池中,负极发生失电子的氧化反应;
②根据盖斯定律来计算化学反应的焓变.
解答:解:(1)E单质的相对分子质量M=ρVm=3.17g.L-1×22.4L/mol=71g/mol,所以为氯气,用石灰水吸收氯气反应的离子方程式味:Cl2+2OH-=Cl-+ClO-+2H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+2H2O;
(2)①根据图象数据,用甲烷表示的平均反应速率v=
=
=0.001mol/(L?min),氢气的反应速率是甲烷化学反应速率的3倍,故用H2表示的平均反应速率为0.0030mol?L-1?min-1,故答案为:0.0030mol?L-1?min-1;
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数=
=2.25×10-4 (mol/L)2,故答案为:<;2.25×10-4;
③温度降低,化学反应速率减小,故答案为:减小;
(3)①在燃料电池中,负极发生失电子的氧化反应,即N2H4+4OH-→N2↑+4H2O+4e-,故答案为:N2H4+4OH-=N2↑+4H2O+4e-;
②根据题意已知反应a、N2H4(1)+2H2O2(1)=4H2O(1)+N2(g)△H=-641.5kJ?mol-1;
b、H2O(1)=H2O(g)△H=+44kJ?mol-1;
c、2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1;
根据盖斯定律得,反应:N2H4(1)+O2(g)=N2(g)+2H2O(1)等于a-c+2b,所以N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1,故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1.
故答案为:Cl2+2OH-=Cl-+ClO-+2H2O;
(2)①根据图象数据,用甲烷表示的平均反应速率v=
| △c |
| △t |
| 0.01mol/L×0.5 |
| 5min |
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数=
| 0.005×0.0153 |
| 0.005×0.015 |
③温度降低,化学反应速率减小,故答案为:减小;
(3)①在燃料电池中,负极发生失电子的氧化反应,即N2H4+4OH-→N2↑+4H2O+4e-,故答案为:N2H4+4OH-=N2↑+4H2O+4e-;
②根据题意已知反应a、N2H4(1)+2H2O2(1)=4H2O(1)+N2(g)△H=-641.5kJ?mol-1;
b、H2O(1)=H2O(g)△H=+44kJ?mol-1;
c、2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1;
根据盖斯定律得,反应:N2H4(1)+O2(g)=N2(g)+2H2O(1)等于a-c+2b,所以N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1,故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1.
点评:本题考查学生化学反应速率、化学平衡移动以及盖斯定律的应用等方面知识.综合性强,难度大.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.