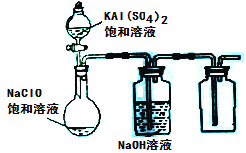
题目内容
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A.前 5 min 的平均反应速率为v(SO2) = 0.08 mol/(L·min)
B.保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时, v正 > v逆
C.保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D.相同条件下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%
【答案】D
【解析】
A.反应在前5min的平均速率为v(SO2)=![]() =
=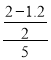 mol/(Lmin)=0.08molL-1min-1,故A正确;
mol/(Lmin)=0.08molL-1min-1,故A正确;
B. 2SO2(g)+O2(g)2SO3(g)
初始量: 2 1 0
变化量:1.2 0.6 1.2
平衡量:0.8 0.4 1.2
化学平衡常数K=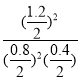 =
=![]() ,温度不变,向平衡后的容器中再充入0.2molSO2和0.2molSO3时,此时Qc=
,温度不变,向平衡后的容器中再充入0.2molSO2和0.2molSO3时,此时Qc=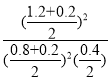 =
=![]() >
>![]() ,化学平衡正向移动,v(正)>v(逆),故B正确;
,化学平衡正向移动,v(正)>v(逆),故B正确;
C.通过计算,当反应进行到10min时,二氧化硫的物质的量是0.8mol,所以10min就达到化学平衡状态,此时反应放出的热量是0.6×196kJ=117.6kJ,起始时向容器中充入2molSO3,达到的平衡和充入2molSO2以及1molO2建立的平衡是等效的,互为逆反应的过程是吸热的,所以达平衡时吸收78.4kJ的热量,故C正确;
D.起始时向容器中充入1.5molSO3,如果平衡时转化率为40%,则
2SO2(g)+O2(g)2SO3(g)
初始量: 0 0 0.75
变化量:0.3 0.15 0.3
平衡量:0.3 0.15 0.45
此时K=![]() ≠
≠![]() ,说明不是平衡状态,故D错误;
,说明不是平衡状态,故D错误;
故选D。