题目内容
【题目】下列实验对应的结论正确的是
选项 | A | B | C | D |
装置 |
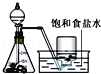
|
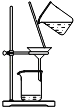
|
|
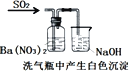
|
结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
A. A B. B C. C D. D
【答案】D
【解析】
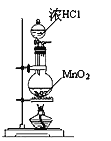
A.用浓盐酸与二氧化锰制氯气,要加热;
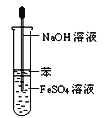
B.盐酸易挥发,盐酸与硅酸钠反应;
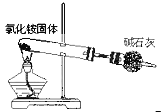
C.碘不易溶于水,易溶于四氯化碳;
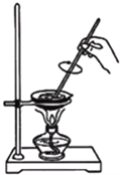
D.发生氧化还原反应生成硫酸钡沉淀.
A.用浓盐酸与二氧化锰制氯气,要加热,故A错误;
B.盐酸易挥发,盐酸与硅酸钠反应,且盐酸为无氧酸,则不能比较非金属性,故B错误;
C.碘不易溶于水,易溶于四氯化碳,过滤不能分离出碘,应用萃取分液,故C错误;
D.发生氧化还原反应生成硫酸钡沉淀,3SO2+2H2O+3Ba(NO3)2=3BaSO4+2NO↑+4HNO3,故D正确;
故选D。

【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了_________________。
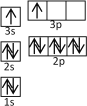
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由________________。
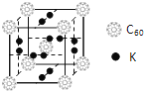
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为______。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。