题目内容
【题目】以H2+Cl2=2HCl为例分析反应过程中能量的变化:
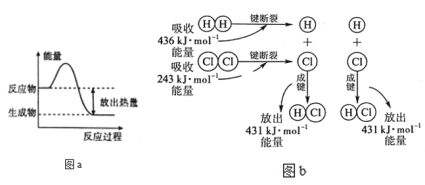
(1)由图a可知:反应物所具有的总能量__生成物所具有的总能量(填“大于、小于或等于”),所以该反应要___(吸收或放出)能量,能量变化值的大小△E=____(用E反和E生表示)。
(2)由图b可知:断裂反应物中的化学键吸收的总能量为E吸=___kJ;形成生成物中的化学键放出的总能量为E放=_____kJ。所以该反应要____(填“吸收” 或“放出”)____kJ(填数值)的能量。
【答案】大于 放出 E反-E生 679 862 放出 183
【解析】
氢气在氯气中燃烧是放热反应,结合反应热和反应物总能量与生成物总能量的关系以及与键能的关系分析解答。
(1)由图a可知反应物所具有的总能量大于生成物所具有的总能量,所以该反应要放出能量,能量变化值的大小△E=E反-E生。
(2)由图b可知断裂反应物中的化学键吸收的总能量为E吸=(436+243)kJ=679kJ;形成生成物中的化学键放出的总能量为E放=2×431kJ=862kJ,所以该反应要放出862kJ-679kJ=183kJ的能量。

 阳光课堂课时优化作业系列答案
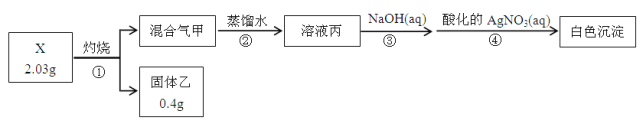
阳光课堂课时优化作业系列答案【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
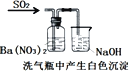
【题目】下列实验对应的结论正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
A. A B. B C. C D. D