题目内容
6.工业合成氨的反应:N2+3H2?2NH3是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂.已知形成1 mol H-H键、1mol N-H键、1mol N≡N键放出的能量分别为436kJ、391kJ、946kJ.则:(1)若1mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量92kJ.
(2)如果将1mol N2和3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是合成氨是可逆反应,反应物不能完全转化.
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是aef.
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2和H2的浓度相等
d.N2、H2和NH3的体积分数相等
e.容器中混合气体的密度保持不变
f.容器内的压强保持不变.
分析 (1)△H=反应物键能和-生成物键能和;
(2)合成氨是可逆反应,反应物不能完全转化;
(3)化学平衡状态是正逆反应速率相等,各组分浓度保持不变的状态,反应达到最大限度,据此分析.
解答 解:(1)△H=反应物键能和-生成物键能和,反应N2+3H2?2NH3中△H=(946+3×436-6×391)kJ/mol=-92kJ/mol,所以正反应放热,故答案为:放出;92;
(2)合成氨是可逆反应,反应物不能完全转化,故答案为:合成氨是可逆反应,反应物不能完全转化;
(3)a.正反应速率和逆反应速率相等,说明反应达到平衡状态,故正确;
b.正反应速率最大,逆反应速率为0,是指反应开始时的状态,反应没有达到平衡状态,故错误;
c.N2和H2的浓度相等,反应不一定达到平衡状态,故错误;
d.N2、H2和NH3的体积分数相等,与平衡状态无关,故错误;
e.当合成氨反应达到化学平衡时,总质量和体积都不变,所以密度保持不变,故正确;
f.当合成氨反应达到化学平衡时,气体总物质的量不变,所以压强保持不变,故正确;
故答案为:aef.
点评 本题考查了据键能计算焓变、可逆反应的焓变、化学平衡状态的判断,题目难度不大.

练习册系列答案
相关题目
17.下列现象与氢键的作用有关的是( )
①NH3、HF、H2O的熔、沸点比同族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素[CO(NH2)2]的熔、沸点比醋酸的高
⑤DNA的结构和生物活性
⑥水分子高温下也很稳定
⑦SiO2的硬度大,熔沸点高
⑧干冰用于人工降雨
⑨SO3与水的反应是放热反应.
①NH3、HF、H2O的熔、沸点比同族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素[CO(NH2)2]的熔、沸点比醋酸的高
⑤DNA的结构和生物活性
⑥水分子高温下也很稳定
⑦SiO2的硬度大,熔沸点高
⑧干冰用于人工降雨
⑨SO3与水的反应是放热反应.
| A. | ①②③④⑤ | B. | ②③④⑤⑥⑦ | C. | ①②④⑤⑨ | D. | ①②③⑤⑧ |
1.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂不参加化学反应 | |
| D. | 任何化学反应,都需要催化剂 |
11.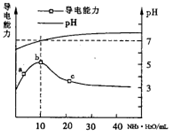 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
所得溶液pH及导电性变化如图.下列分析不正确的是( )
 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |
18.“化学,我们的生活,我们的未来”曾经是2011年“国际化学年”的主题.你认为下列行为中,不符合这一主题的是( )
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 开发太阳能、水能、风能等新能源、减少使用煤、石油等化石燃料 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
15.下列说法不正确的是( )
| A. | 无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值 | |
| B. | 鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水 | |
| C. | 苯中的少量苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| D. | 苯酚的酸性很弱,但可以和Na2CO3反应 |
16.MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,则下列有关该电池的说法正确的是( )
| A. | 随着反应的进行,CO32-在不断消耗 | |
| B. | 该电池的正极的反应式为:4OH-+4e-=O2+2H2O | |
| C. | 放电时CO32-向正极移动 | |
| D. | 该电池负极的反应为:H2+CO32--2e-=H2O+CO2 |

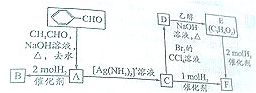
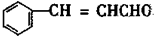 B
B C
C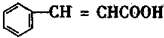 D
D
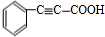 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$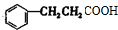 ;加成反应;.
;加成反应;.
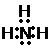 、E的结构式H-O-H、F的化学式为Fe3O4.
、E的结构式H-O-H、F的化学式为Fe3O4.