题目内容
9.已知醛在一定条件下可以两分子加成:
产物不稳定,受热即脱水而生成不饱和酸.
又知:R-CH2-CH2X$→_{Na溶液,△}^{乙醇}$R-CH═CH2(X为卤素原子).
A是一种可以作为药物的有机化合物,分析下列反应图示中各有机化合物之间的关系,(所有生成无机物均已略去未写),请回答下列问题:
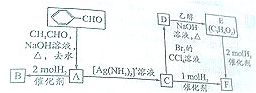
(1)请写出有机化合物A、B、C、D的结构简式.
A
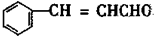 B
B C
C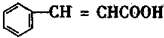 D
D
(2)请写出E→F的化学方程式,并说明反应类型:
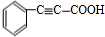 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$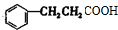 ;加成反应;.
;加成反应;.
分析 根据给予信息知,苯甲醛和乙醛发生加成反应生成A,则A的结构简式为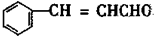 ,A和2mol氢气发生加成反应生成B,A中的碳碳双键和醛基与氢气发生加成反应生成B,所以B的结构简式为
,A和2mol氢气发生加成反应生成B,A中的碳碳双键和醛基与氢气发生加成反应生成B,所以B的结构简式为 ,A和银氨溶液反应生成C,A中的醛基被氧化生成羧酸C,则C的结构简式为
,A和银氨溶液反应生成C,A中的醛基被氧化生成羧酸C,则C的结构简式为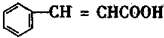 ,C和溴单质发生加成反应生成D,D为
,C和溴单质发生加成反应生成D,D为 ,D和氢氧化钠的醇溶液发生消去反应E,E的结构简式为
,D和氢氧化钠的醇溶液发生消去反应E,E的结构简式为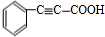 ,C和1mol氢气发生加成反应生成F,F的结构简式
,C和1mol氢气发生加成反应生成F,F的结构简式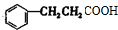 ,据此解答.
,据此解答.
解答 解:根据给予信息知,苯甲醛和乙醛反应生成A,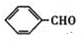 +CH3CHO$→_{△}^{NaOH}$→
+CH3CHO$→_{△}^{NaOH}$→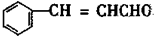 +H2O,则A的结构简式为
+H2O,则A的结构简式为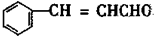 ,A中的碳碳双键和醛基与氢气发生加成反应生成B,A和2mol氢气发生加成反应生成B
,A中的碳碳双键和醛基与氢气发生加成反应生成B,A和2mol氢气发生加成反应生成B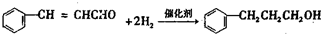 ,所以B的结构简式为
,所以B的结构简式为 ,A和银氨溶液反应反应生成C,A中的醛基被氧化生成羧酸C,
,A和银氨溶液反应反应生成C,A中的醛基被氧化生成羧酸C, +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$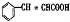 +2Ag↓+4NH3↑+2H2O,则C的结构简式为
+2Ag↓+4NH3↑+2H2O,则C的结构简式为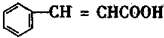 ,C和溴发生加成反应生成D,
,C和溴发生加成反应生成D,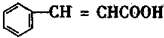 +Br2→
+Br2→ ,D为
,D为 ,D和氢氧化钠的醇溶液发生消去反应E,
,D和氢氧化钠的醇溶液发生消去反应E, +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$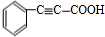 +2NaBr+2H2O,E的结构简式为
+2NaBr+2H2O,E的结构简式为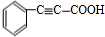 ,C和1mol氢气发生加成反应生成F,
,C和1mol氢气发生加成反应生成F,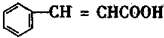 +H2$\stackrel{一定条件}{→}$
+H2$\stackrel{一定条件}{→}$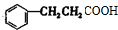 ,F的结构简式为
,F的结构简式为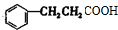 ,
,
(1)通过以上分析知,A的结构简式为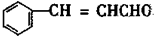 ,B的结构简式为
,B的结构简式为 ,C的结构简式为
,C的结构简式为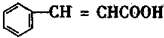 ,D的结构简式为
,D的结构简式为 ,
,
故答案为: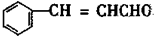 ;
; ;
;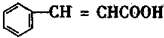 ;
; ;
;
(2)E的结构简式为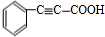 和2mol氢气发生加成反应生成F,
和2mol氢气发生加成反应生成F,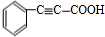 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$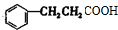 ,
,
故答案为: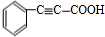 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$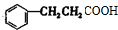 ;加成反应;
;加成反应;
点评 本题考查了有机物的推断,题目难度中等,需要学生对反应信息进行利用,根据反应的条件进行顺推判断,掌握官能团的转化以及根据给予信息知,苯甲醛和乙醛发生加成反应生成A是解答关键.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
19.下列叙述正确的是( )
| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
20.下列不能证明反应N2(g)+3H2(g)?2NH3(g)已达到化学反应的限度的是( )
| A. | v正(NH3)=3v逆(H2) | |
| B. | 1个N≡N键断裂的同时有6个N-H键断裂 | |
| C. | 反应体系压强不再变化 | |
| D. | 混合气体质量不再变化 |
17.元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是( )
| A. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| B. | 同一元素不可能既表现金属性,又表现非金属性 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
4.下列四支试管中,双氧水分解的化学反应速率最大的是( )
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| A | 室温(25℃) | 12% | MnO2 |
| B | 室温(25℃) | 4% | 无 |
| C | 水浴加热(50℃) | 12% | 无 |
| D | 水浴加热(50℃) | 12% | MnO2 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法不正确的是( )
| A. | 溶液中滴加盐酸酸化的BaCl2溶液出现被色沉淀,则溶液中不一定存在SO${\;}_{4}^{2-}$ | |
| B. | 形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 | |
| C. | 氯气泄漏自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离 | |
| D. | 大气中的N2可转化为NO,NO可转化为NO2、硝酸等,含硫物质在自然界中可转化为SO2等含硫化合物 |
1.下列有关说法合理的是( )
| A. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| B. | 用50ml酸式滴定管可准确量取25.00ml KMnO4 溶液 | |
| C. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| D. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比为2:1 |
5.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
①T3℃时,该反应的平衡常数K=0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
| 浓度/mol.L-1 | NO | N2 | CO2 |
| 时间/min | |||
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.30 | 0.030 |
| 30 | 0.040 | 0.30 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).