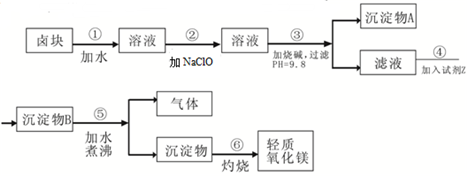
��Ŀ����
������ʵ���������ȷ����
��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijѧУ��ѧС����ʵ��ķ�������̽��������ֻ����Cu��Fe��Mg�Ͳ�ͬŨ�ȵ����ᣨ0.5mol/L��2mol/L��18.4mol/L�������ʵ�鷽����̽��Ӱ�컯ѧ��Ӧ���ʵ����ء���ͬѧ��ʵ�鱨�����±���
��1����ͬѧ����ʵ�鲽���Ϊ ��
��2����ͬѧ��ʵ��Ŀ����̽�� ��
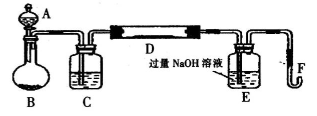
��ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý��ж���ʵ�顣

��3����ͬѧ��ʵ����Ӧ�òⶨ�������� ��
��4����ͬѧ���ʵ��Ӧѡ�õ�ʵ��ҩƷ�� ��
| A����Һʱ����Һ©���²�Һ����¶˷ų����ϲ�Һ����Ͽڵ��� |
| B������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿ� |
| C�������ᾧʱӦ����Һֱ������ |
| D�������Ǹ�ʴ��ҩƷӦ����������ƽ���̵ij���ֽ�ϣ��������������ƽ���̵ij���ֽ�� |
| ʵ�鲽�� | ���� | ���� |
| �ٷֱ�ȡ�����2mol/L���������Թ��� �� | Mg�����������ʿ���Fe��Cu�����Ա仯 | ��������Խ���ã���Ӧ����Խ�� |
��2����ͬѧ��ʵ��Ŀ����̽�� ��
��ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý��ж���ʵ�顣

��3����ͬѧ��ʵ����Ӧ�òⶨ�������� ��
��4����ͬѧ���ʵ��Ӧѡ�õ�ʵ��ҩƷ�� ��
��11�֣���3�֣�ѡ��1����1�֣��������÷֣�ȫѡ���÷֣�ABD
��8�֣�ÿ��2�֣���1���ֱ�Ͷ����״����С��ͬ��Cu��Fe��Mg
��2��̽����������Ӧ������������뷴Ӧ���ʵĹ�ϵ���¶���ͬ
��3���ⶨͬһ������Ũ�Ȳ�ͬ�������ͬ���������һ���������������Ҫ��ʱ���ڣ�����һ��ʱ���ڲ������������� ��4��Mg����Fe����0.2mol/L�����2mol/L����
��8�֣�ÿ��2�֣���1���ֱ�Ͷ����״����С��ͬ��Cu��Fe��Mg
��2��̽����������Ӧ������������뷴Ӧ���ʵĹ�ϵ���¶���ͬ
��3���ⶨͬһ������Ũ�Ȳ�ͬ�������ͬ���������һ���������������Ҫ��ʱ���ڣ�����һ��ʱ���ڲ������������� ��4��Mg����Fe����0.2mol/L�����2mol/L����
�����������Һʱ����Һ©���²�Һ����¶˷ų����ϲ�Һ����Ͽڵ�����Aѡ����ȷ������ʱ���¶ȼƲ������������¶ȣ�����Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿڴ���ѡ��B��ȷ�������ᾧʱ�����ִ�������ʱ����ֹͣ���ȣ������������ɣ�ѡ��C����ȷ�������Ǹ�ʴ��ҩƷӦ����������ƽ���̵ij���ֽ�ϣ��������������ƽ���̵ij���ֽ�ϣ�ѡ��D��ȷ����ѡABD��
��1�����ݼ�ͬѧ��ʵ����̿�֪����ʵ����ͨ���۲첻ͬ�Ľ�������ͬ��ϡ���ᷴӦ�ķ�Ӧ������̽��̽����������Ӧ������������뷴Ӧ���ʵĹ�ϵ��������ѡ�õ�ʵ��ҩƷΪ��ͬ��Ũ�ȵ����ᣬ��ͬ�Ľ�������˼�ͬѧ����ʵ�鲽���Ϊ�ֱ�Ͷ����״����С��ͬ��Cu��Fe��Mg��
��2���������Ϸ�����֪����ͬѧ��ʵ��Ŀ����̽��̽����������Ӧ������������뷴Ӧ���ʵĹ�ϵ��Ϊ��֤ʵ���ȷ�ԣ���Ҫ��֤ʵ��ʱ��Һ���¶�����ͬ�ġ�
��Ӧ���ʵı�ʾ����Ϊ��λʱ���ڷ�Ӧ��Ũ�ȵļ��٣���������Ũ�ȵ����ӣ�̽����ͬŨ�ȵ�����Է�Ӧ���ʵ�Ӱ�죬���Կ��Բ������������������������������ʱ�䣬�ʴ�Ϊ���ⶨһ��ʱ���������������߲ⶨһ����������������ʱ�䣩��
��3����װ�����Ϊ��ҹ©������ƿ����Һ©��Ϊ��Һ�壬��ƿΪ��Ӧ�������ұ�Ϊ����װ�ã��Ҹ�װ�ò�����ȣ���ʵ���Ŀ��Ϊ̽����ͬŨ�ȵ�ϡ��������ͬ������Ӧ�ķ�Ӧ���ʣ����е��Ƕ���ʵ�飬������ͬѧ��ʵ����Ӧ�òⶨ�������Dzⶨͬһ������Ũ�Ȳ�ͬ�������ͬ���������һ���������������Ҫ��ʱ�䣨����һ��ʱ���ڲ���������������
��4���������Ϸ�����֪����ͬѧ���ʵ��Ӧѡ�õ�ʵ��ҩƷ��Mg����Fe����0.2mol/L�����2mol/L���ᡣ
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣���ض�ѧ��ʵ�������Ŀ��飬����������ѧ���淶�Ͻ���ʵ�������������ȷʵ��ԭ���Ǵ���Ĺؼ�������������Ҫ���Գ���������ѡ�á�ʵ���������Ϊ���ģ�ͨ����ʲô��Ϊʲô���������ص㿼��ʵ����������Ĺ淶�Ժ�ȷ�Լ��������֪ʶ���ʵ�������������

��ϰ��ϵ�д�
 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
�����Ŀ