题目内容
(14分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN—生成N2、CO2、和SO42—,也可以将Fe2+氧化成 Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就以Fe3+的形式存在:②在制药过程中生成少量Fe3+;
②本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 红色又逐渐褪去的原因可能是
设计实验证明你的推测
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性。怎样理解药品说明书中所述“与VC(维生素C)同服可增加本品吸收”这句话?
。
第一步:查阅资料得知,双氧水可以氧化SCN—生成N2、CO2、和SO42—,也可以将Fe2+氧化成 Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就以Fe3+的形式存在:②在制药过程中生成少量Fe3+;
②本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 红色又逐渐褪去的原因可能是
设计实验证明你的推测
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性。怎样理解药品说明书中所述“与VC(维生素C)同服可增加本品吸收”这句话?
。
(14分)每空各2分
第二步:Fe2+ 第三步:②③
第五步:2Fe2++H2O2+2H+ ==2Fe3++2H2O Fe3++3SCN-==Fe(SCN)3
H2O2氧化SCN—红色消失
向A试管,继续加入少量几滴KSCN溶液,溶液又变为红色,说明推测正确
第六步:还原
Fe2+在人体血红蛋白中起传送O2的作用,Fe3+无此功能,服用Vc可防止药品中的Fe2+氧化成Fe3+
第二步:Fe2+ 第三步:②③
第五步:2Fe2++H2O2+2H+ ==2Fe3++2H2O Fe3++3SCN-==Fe(SCN)3
H2O2氧化SCN—红色消失
向A试管,继续加入少量几滴KSCN溶液,溶液又变为红色,说明推测正确
第六步:还原
Fe2+在人体血红蛋白中起传送O2的作用,Fe3+无此功能,服用Vc可防止药品中的Fe2+氧化成Fe3+
考查了Fe2+、Fe3+的性质、转化与检验,前者为浅绿色,还原性较强,易被氧化为后者。后者经常用KSCN呈现出的血红色来检验。
第五步:Fe2+在酸性情况下,滴入H2O2溶液:2Fe2++H2O2+2H+ ==2Fe3++2H2O,产生Fe3+,Fe3+浓度增大,与KSCN生成的血红色络合物浓度增大,颜色加深;
但由题意得到,H2O2溶液还可氧化破坏KSCN,导致血红色褪去。
第六步:Vc具有还原性,是化学常识。它的存在可还原Fe3+、防止Fe2+被氧化。
第五步:Fe2+在酸性情况下,滴入H2O2溶液:2Fe2++H2O2+2H+ ==2Fe3++2H2O,产生Fe3+,Fe3+浓度增大,与KSCN生成的血红色络合物浓度增大,颜色加深;
但由题意得到,H2O2溶液还可氧化破坏KSCN,导致血红色褪去。
第六步:Vc具有还原性,是化学常识。它的存在可还原Fe3+、防止Fe2+被氧化。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
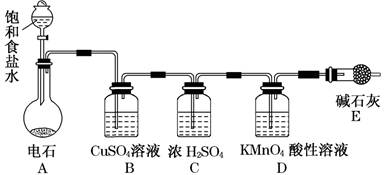
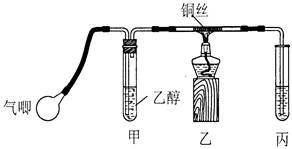
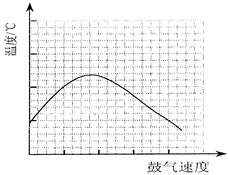
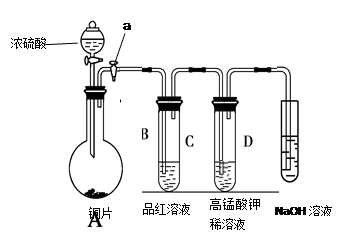
 _________________(2分).
_________________(2分).