题目内容
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
【答案】 B A 1.8×10-5或10-4.74 2×10-5-2×10-9 NH3+NH3![]() NH4++NH2- CO32-+2NH3
NH4++NH2- CO32-+2NH3![]() NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
【解析】I.(1)本题考查影响化学反应速率的因素和化学平衡的移动,A、降低温度,化学反应速率降低,故A错误;B、合成氨:N2+3H2 ![]() 2NH3,压缩反应混合物,增大压强,化学反应速率加快,促使平衡向正反应方向移动,NH3的体积分数增大,故B正确;C、充入N2,正反应方向速率加快,总气体物质的量增大,氨气的体积分数可能减小,故错误;D、分离出NH3,此时正反应速率不变,故D错误;(2)本题考查电离常数、离子浓度大小比较,(2)①根据题意,向NH3·H2O中滴加HCl,发生NH3·H2O+HCl=NH4Cl+H2O,NH3·H2O的浓度降低,根据图像,即A曲线代表NH3·H2O浓度的变化;②电离常数Kb=
2NH3,压缩反应混合物,增大压强,化学反应速率加快,促使平衡向正反应方向移动,NH3的体积分数增大,故B正确;C、充入N2,正反应方向速率加快,总气体物质的量增大,氨气的体积分数可能减小,故错误;D、分离出NH3,此时正反应速率不变,故D错误;(2)本题考查电离常数、离子浓度大小比较,(2)①根据题意,向NH3·H2O中滴加HCl,发生NH3·H2O+HCl=NH4Cl+H2O,NH3·H2O的浓度降低,根据图像,即A曲线代表NH3·H2O浓度的变化;②电离常数Kb= 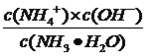 ,电离常数只受温度的影响,因此取的数值为pH=9.26,c(NH4+)=c(NH3·H2O),即Kb=10-4.74;③根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),根据物料守恒,c(NH4+)+c(NH3·H2O)=2c(Cl-),两者推出c(NH4+)-c(NH3·H2O)=2c(OH-)-2c(H+)=2(10-5-10-9);II.考查电离方程式的书写,(1)液氨电离与水的电离类似,因此液氨的电离方程式为NH3+NH3
,电离常数只受温度的影响,因此取的数值为pH=9.26,c(NH4+)=c(NH3·H2O),即Kb=10-4.74;③根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),根据物料守恒,c(NH4+)+c(NH3·H2O)=2c(Cl-),两者推出c(NH4+)-c(NH3·H2O)=2c(OH-)-2c(H+)=2(10-5-10-9);II.考查电离方程式的书写,(1)液氨电离与水的电离类似,因此液氨的电离方程式为NH3+NH3![]() NH4++NH2-;(2)根据盐类水解的定义,即一级氨解的离子方程式为:CO32-+2NH3
NH4++NH2-;(2)根据盐类水解的定义,即一级氨解的离子方程式为:CO32-+2NH3![]() NH2-+NH4CO3- ;(3)氨解中存在CO32-+2NH3
NH2-+NH4CO3- ;(3)氨解中存在CO32-+2NH3![]() NH2-+NH4CO3-,NH3+NH3
NH2-+NH4CO3-,NH3+NH3![]() NH4++NH2-,氨解的程度微弱,因此离子浓度大小顺序是c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)。
NH4++NH2-,氨解的程度微弱,因此离子浓度大小顺序是c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案


