题目内容
【题目】已知:Fe(OH)3的Ksp=2.79×10-39,Al(OH)3的Ksp=1.3×10-31。现将20 mL 0.05 mol/L FeCl3和20 mL 0.05 mol/L AlCl3混合,再向溶液中逐滴加入0.10 mol/L NaOH溶液,测定溶液的pH变化如图所示,则下列说法不正确的是( )
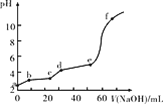
A.a点处,Al3+水解程度比Fe3+水解程度大
B.bc段主要产生Fe(OH)3沉淀
C.de段主要反应:Al3++3OH-=Al(OH)3↓
D.向f点所得溶液中通入足量CO2,沉淀的质量会变大
【答案】A
【解析】
Fe3+水解平衡Fe3++3H2OFe(OH)3+3H+,水解平衡常数Kh(Fe3+)=c3(H+)÷c(Fe3+)=K3w÷Ksp[Fe(OH)3],同理可得Kh(Al3+)=K3w÷Ksp[Al(OH)3]。
A.由于Ksp[Al(OH)3]>Ksp[Fe(OH)3],即Kh(Fe3+)>Kh(Al3+),故a点处Fe3+水解程度比Al3+水解程度大,故A错误;
B.随着NaOH溶液的滴加,Fe3+先沉淀,Al3+后沉淀,bc段主要产生Fe(OH)3沉淀,故B正确;
C.de段主要产生Al(OH)3沉淀,故C正确;
D.f点的pH>10,故Al(OH)3已经全部溶解生成AlO2,沉淀只为Fe(OH)3,此时若通入足量CO2,发生反应AlO2+CO2+2H2O=Al(OH)3↓+HCO3,重新生成Al(OH)3沉淀,碳酸酸性很弱,并不能溶解Fe(OH)3和Al(OH)3,则沉淀总质量增加,故D正确;
故选:A。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目