题目内容
5.下列关于“一定”说法正确的句数是( )①pH=6的溶液一定是酸性溶液.
②c(H+)>c (OH-)一定是酸性溶液.
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力.
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14.
⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
⑧使用pH试纸测定溶液pH时若先润湿,则测得溶液的pH一定有影响.
| A. | 0句 | B. | 1句 | C. | 2句 | D. | 3句 |
分析 ①②溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小;③电解质溶液导电能力与离子浓度成正比;④在酸碱溶液中水的电离受到抑制;⑤水为弱电解质,存在水的电离平衡;⑥氢硫酸是弱电解质,加水稀释氢硫酸溶液,促进电离,电离产生的硫氢根离子和氢离子数目增多浓度减小;⑦温度不变,向水中加入含有弱根离子的盐对水的电离有影响;⑧如溶液呈中性,则pH不变.
解答 解:①溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小,100℃时,水的pH=6,但是水呈中性,故错误;②溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小,如果c(OH-)>c(H+),溶液呈碱性,如果c(OH-)=c(H+),溶液呈中性,如果c(OH-)<c(H+),溶液呈酸性,如果酸的浓度很小,则c(H+)很小,但溶液仍可能呈酸性,故正确;③电解质溶液导电能力与离子浓度成正比,与电解质强弱无关,所以强电解质溶液的导电能力不一定大于弱电解质溶液的导电能力,故错误;④在酸碱溶液中水的电离受到抑制,所以在酸碱溶液中25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定小于10-14,故错误;⑤Na2Y的水溶液中存在水的电离平衡,故错误;⑥加水稀释氢硫酸,电离程度增大,但是氢离子浓度减小,故错误;⑦温度不变,向水中加入不水解的盐,不影响水的电离,如果向水中加入含有弱根离子、能电离出氢离子的盐则影响水电离,故错误;⑧pH不能事先湿润,湿润后如溶液呈中性,则pH不变,故错误,故选B.
点评 本题主要考查的是水的电离以及其影响因素,涉及水的离子积常数,溶液酸碱性判断、pH试纸的正确使用以及盐类的水解等,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.人体内最重要的供能物质是( )
| A. | 葡萄糖 | B. | 纤维素 | C. | 油脂 | D. | 蛋白质 |
9.下列离子方程式书写正确的是( )
| A. | 碳酸钙溶于醋酸溶液中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯化镁溶液和氨水混合:Mg2++2OH-═Mg(OH)2 | |
| C. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| D. | 铝片插入硝酸银溶液中 Al+3Ag+═Al3++3Ag |
10.25℃时,电离平衡常数:
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是e c d b a(填字母).
(2)常温下,0.1mol/L的CH3COOH溶液的pH═2.85(已知lg2=0.3).
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式CO2+NaClO+H2O=NaHCO3+HClO.
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(用准确的数值表示)
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是e c d b a(填字母).
(2)常温下,0.1mol/L的CH3COOH溶液的pH═2.85(已知lg2=0.3).
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式CO2+NaClO+H2O=NaHCO3+HClO.
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(用准确的数值表示)
17.下列表达正确的是( )
| A. | HClO的电子式为 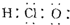 | |
| B. | H2S的电子式可表示为 | |
| C. | 用电子式表示Na2O的形成过程为2Na×+ →2Na+ →2Na+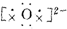 | |
| D. | MgCl2的电子式为 Mg2+ Mg2+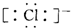 |
15.以下符号正确的是( )
| A. | 2d1 | B. | 3f7 | C. | 6s3 | D. | 7p2 |
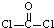 ,分子构型为平面三角形
,分子构型为平面三角形