题目内容
13.研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.(1)C、Si、N元素的第一电离能由大到小的顺序是N>C>Si.金刚石和晶体硅都是原子晶体,结构相似但金刚石熔点比晶体硅高,其原因是二者都是原子晶体,金刚石键能大于晶体硅,所以熔点高.
(2)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙酸中碳原子的杂化轨道类型为sp3、sp2,1mol乙酸分子中含有的σ键与数目为6NA.Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个铜原子.
(3)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2的结构式为
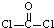 ,分子构型为平面三角形
,分子构型为平面三角形②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5═e(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是金属键.
分析 (1)根据元素的电负性在周期表中的递变规律判断C、Si、N元素的电负性由大到小的顺序;金刚石和晶体硅都是原子晶体,键能越大,熔点越高;
(2)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(3)①COCl2中C=O键中含有1个δ键,1个π键,据此书写COCl2的结构式,根据杂化轨道类型判断;
②根据生成物判断形成的化学键.
解答 解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>C>Si,原子晶体中,晶体熔沸点高低取决于微粒间形成的共价键的强弱,而强弱又取决于共价健的键长和键能,键长越短、键能越大,原子晶体熔沸点越高,金刚石和晶体硅都是原子晶体,键长大小顺序是C-C<Si-Si,键能大小顺序是C-C>Si-Si,所以金刚石熔点比晶体硅高,
故答案为:N>C>Si;二者都是原子晶体,金刚石键能大于晶体硅,所以熔点高;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,
故答案为:sp3、sp2;6NA;CH3COOH存在分子间氢键;16;
(3)①COCl2中C=O键中含有1个δ键,1个π键,COCl2分子的结构式为: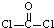 ,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,中心原子含有3个σ键且不含孤电子对,所以其空间构型是平面三角形,
,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,中心原子含有3个σ键且不含孤电子对,所以其空间构型是平面三角形,
故答案为: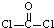 ;平面三角形;
;平面三角形;
②根据原子守恒,e为Fe,Fe(CO)5中Fe与CO之间形成配位键,Fe(CO)5═Fe(s)+5CO反应过程中,断裂的化学键只有配位键,由于反应生成Fe,故形成金属键,
故答案为:金属键.
点评 本题考查了电离能、晶体的结构、杂化原理的应用等,综合性强,为历年高考选做常考题型,注意(2)晶体结构的求解,题目难度中等.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 用H2O2分解制氧气,消耗1mol H2O2,转移电子为2 mol | |
| B. | 0.5mol H2和0.5 molO2的混合气体为22.4 L | |
| C. | 16g O2和O3的混合气体中含有氧原子数目为NA | |
| D. | 在反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中,每生成1mol Cl2有4mol HCl被氧化 |
| A. | 侯德榜 | B. | 李四光 | C. | 华罗庚 | D. | 邓稼先 |
 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是Q1<Q3<Q2(用Q1、Q2、Q3表示).
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是Q1<Q3<Q2(用Q1、Q2、Q3表示).(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量散失; 若实验中不加盖泡沫塑料板,则求得的中和热数值偏小(填偏大、偏小、无影响)
(3)实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用如图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
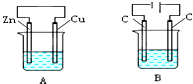 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
 .
.