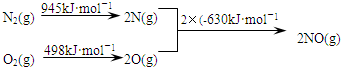题目内容
15.以下符号正确的是( )| A. | 2d1 | B. | 3f7 | C. | 6s3 | D. | 7p2 |
分析 A.第二能层有2个能级,分别为2s、2p能级;
B.第三能层有3个能级,分别为3s、3p、3d能级;
C.S能级只有一个轨道,每个轨道最多容纳2个电子;
D.第七能层有S、P、d、f等能级.
解答 解:A.第二能层只有s、p能级,没有d能级,故A错误;
B.第三能层有3个能级,分别为3s、3p、3d能级,没有f能级,故B错误;
C.S能级只有一个轨道,根据泡利原理知每个轨道最多容纳2个电子,故C错误;
D.第七能层有S、P、d、f等能级,所以7p2是正确的,故D正确;
故选D.
点评 本题考查了原子核外电子的能级排布,题目难度不大,明确各个能层含有的能级是解本题的关键.

练习册系列答案
相关题目
6.假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变.则下列推断不正确的是( )
| A. | 此时16O的相对原子质量为32 | |
| B. | 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L | |
| C. | 标况下44gCO2的体积为22.4L | |
| D. | NA个氧分子与NA个氢分子有相同数目的分子 |
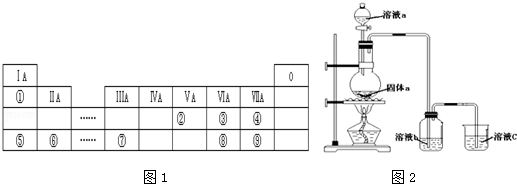
10.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①~⑩中,金属性最强的元素是Na(写元素符号,下同);非金属性最强的元素是F;形成化合物种类最多的元素是C;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是N.
(2)③、③、⑤,其原子半径由大到小的顺序是Na>N>F(写元素符号).
(3)⑧、⑨的氢化物,还原性更强的是H2S(填化学式).
(4)①~⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它的水溶液与⑦的最高价氧化物的水化物反应的离子离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③、③、⑤,其原子半径由大到小的顺序是Na>N>F(写元素符号).
(3)⑧、⑨的氢化物,还原性更强的是H2S(填化学式).
(4)①~⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它的水溶液与⑦的最高价氧化物的水化物反应的离子离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
20.已知2SO2(g)+O2(g)═2SO3(g)(正反应方向放热).若在500℃和催化剂的作用下,往容器中加入SO2和O2,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 随着反应的进行,逆反应速率逐渐增大,最后不变 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
4.常温下,有①Na2CO3溶液;②NaHCO溶液;③氨水;④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol.L-1.关于上述四种溶液的说法正确的是( )
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH+)+c(HCO2-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)+c(NH3.H2O)<0.1mol.L-1 | |
| D. | 向③、④中分别加入25mL0.1mol.L-1盐酸后,溶液中c(NH4+):③<④ |
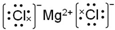 .
.