题目内容
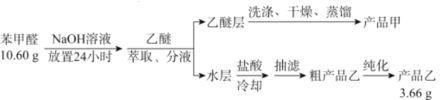
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。
【答案】分液漏斗、烧杯 上口倒出 除去乙醚层中含有的苯甲醛 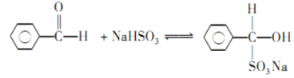 防止暴沸 D 重结晶 60%
防止暴沸 D 重结晶 60%
【解析】
(1)根据仪器名称写出相应的仪器名称;分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出;
(2)饱和亚硫酸氢钠溶液洗涤目的是洗去乙醚层中含有的苯甲醛;
(3)根据碎瓷片的作用及苯甲酸沸点分析;
(4)重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程;
(5)根据产率=![]() 进行计算。
进行计算。
(1)萃取分液用到的玻璃实验仪器名称是分液漏斗、烧杯;乙醚密度小于水,在上层,分液时,乙醚层应从上口倒出;
(2)醛类可以跟亚硫酸氢钠饱和溶液发生加成反应,实验步骤中的饱和亚硫酸氢钠溶液洗涤目的是洗去乙醚层中含有的苯甲醛,饱和碳酸钠溶液除去残留的亚硫酸氢钠;根据题给信息可知,二者发生加成反应,化学方程式为: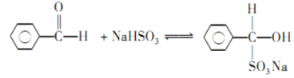 ;
;
(3)蒸馏获得产品甲时加入碎瓷片的目的为防止暴沸,蒸馏时得到产品甲为苯甲酸,应控制温度在249℃左右;
答案选D;
(4)提纯粗产品乙获得产品乙的纯化方法名称为重结晶;
(5)称取10.60g的苯甲醛进行实验,理论上得到苯甲酸的质量为![]() ,最终制取产品乙的质量为3.66g,则产品乙的产率为
,最终制取产品乙的质量为3.66g,则产品乙的产率为![]() 。
。

 名题金卷系列答案
名题金卷系列答案【题目】氯气是一种重要的化工原料。
(1)氯气和石灰乳反应可以制得漂白粉,当漂白粉暴露在空气中因吸收了空气中的CO2和H2O而可能部分变质,写出验证漂白粉已部分变质的实验方法:________。
(2)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空,a、b、c、d中重合部分代表物质间反应,且氯水足量。
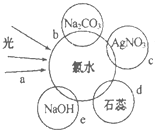
c过程的离子方程式为_______。
e过程中氧化还原反应的化学方程式为________。
d过程所观察到的现象为_______。
b过程证明了氯水中存在_________(填字母)微粒。
A Cl2 B Cl- C HClO DH+
(3)根据下表表弱酸的电离常数,写出二种可以增加饱和氯水中的次氯酸的浓度的钠盐_______。说明选择的理由或条件:_________。
某些弱酸的电离常数(298K) | ||
多元弱酸 | K1 | K2 |
HClO | 2.95×10-8 | |
CH3COOH | 1.76×10-5 | |
H2SO3 | 1.54×10-2 | 1.02×10-17 |
H2CO3 | 4.30×10-7 | 5.61×10-11 |