题目内容
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[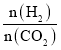 ]的变化如图所示:
]的变化如图所示:
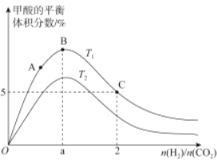
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
【答案】-31.4 < M·HCOOH(s)=HCOOH(g)+M(s) > < 该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2; 1 ![]() >
>![]() >
>![]()
![]()
【解析】
(1)根据盖斯定律进行求算;
(2)①由△G=△H -T△S <0进行判断;
②总反应减去第一步反应可得第二步反应的方程式;
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长;
(3)①该反应为放热反应,升高温度,平衡逆向移动;
②根据反应CO2(g)+H2(g)![]() HCOOH(g)及投料比[
HCOOH(g)及投料比[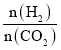 ]进行分析;
]进行分析;
③氢气的量越大,即投料比[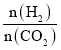 ]越大,CO2的转化率越大;
]越大,CO2的转化率越大;
④根据三段式进行计算。
(1)已知I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
根据盖斯定律,由III![]() -I- II
-I- II![]() 得反应IV:CO2(g)+H2(g)
得反应IV:CO2(g)+H2(g)![]() HCOOH(g) △H = (-483.6kJmol-1)
HCOOH(g) △H = (-483.6kJmol-1)![]() -72.6kJmol-1- (-566.0kJmol-1)
-72.6kJmol-1- (-566.0kJmol-1)![]() =-31.4kJmol-1;
=-31.4kJmol-1;
(2)①第一步反应CO2(g)+H2(g)+M(s)→MHCOOH(s)为熵减的反应,即△S<0,能自发进行,则△G=△H -T△S <0,故△H<0;
②CO2(g)和H2 (g)合成HCOOH(g)的总反应为CO2(g)+H2(g)![]() HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长,则t1>t2;
(3)①该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2;
②根据反应CO2(g)+H2(g)![]() HCOOH(g),当投料比[
HCOOH(g),当投料比[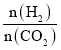 ]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
③氢气的量越大,即投料比[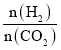 ]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为
]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为![]() >
>![]() >
>![]() ;
;
④T1温度下,在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,C点时投料比[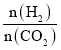 ]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
CO2(g)+H2(g)![]() HCOOH(g)
HCOOH(g)
开始时的浓度(mol/L) 1 2 0
改变的浓度(mol/L) x x x
平衡时的浓度(mol/L)1-x 2-x x
则有![]() ,解得x=
,解得x=![]() ;该反应的平衡常数K=
;该反应的平衡常数K=![]() =
=![]() 。
。

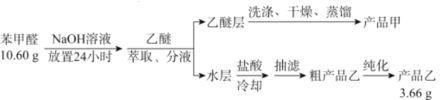
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。