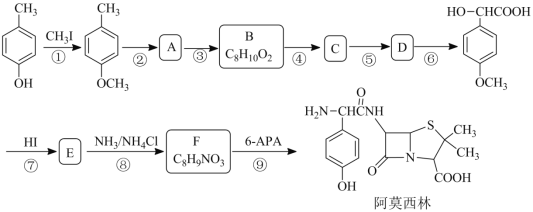
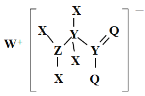题目内容
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的pH与离子浓度变化关系如图所示,下列说法不正确的是

A.L1表示![]() 与pH的变化关系
与pH的变化关系
B.Kb(YOH)=10-10.5
C.a点时两溶液中水的电离程度不相同
D.0.1mol·L-1的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
【答案】D
【解析】
NaX的Kh=![]() ,则
,则![]() =
=![]() ,所以-lg
,所以-lg![]() =-lg
=-lg![]() =-lg
=-lg![]() +lgKh=14-pH+lgKh;同理YCl的Kh′=
+lgKh=14-pH+lgKh;同理YCl的Kh′=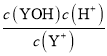 ,则
,则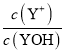 =
=![]() ,-lg
,-lg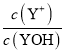 =pH+lgKh′。
=pH+lgKh′。
A.根据以上分析知,-lg![]() =14-pH+lgKh,-lg
=14-pH+lgKh,-lg![]() 越大,溶液的pH值越小;-lg
越大,溶液的pH值越小;-lg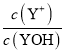 =pH+lgKh′,-lg
=pH+lgKh′,-lg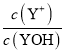 越大,溶液的pH值越大,所以L1表示-lg
越大,溶液的pH值越大,所以L1表示-lg![]() 与pH的变化关系,L2表示-lg
与pH的变化关系,L2表示-lg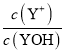 与pH的变化关系,故A正确;
与pH的变化关系,故A正确;
B.当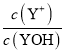 =1时,Kb(YOH)=
=1时,Kb(YOH)=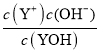 =c(OH-)=
=c(OH-)=![]() =10-10.5,故B正确;
=10-10.5,故B正确;
C.a点溶液呈酸性,NaX溶液含有的HX电离导致溶液呈酸性,YCl溶液中阳离子水解导致溶液呈酸性,所以对于NaX溶液是抑制水电离、对于YCl溶液是促进水电离,故C正确;
D.a点溶液的pH及纵坐标相等,则14-pH+lgKh=pH+lgKh′,根据图知,14-2pH=lgKh′-lgKh>0,说明水解程度YCl>NaX,所以在YX溶液中水解程度Y+>X-,溶液呈酸性,结合电荷守恒得c(X-)>c(Y+)>c(H+)>c(OH-),故D错误;
故选D。

 名校课堂系列答案
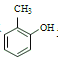
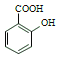
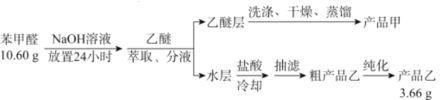
名校课堂系列答案【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。