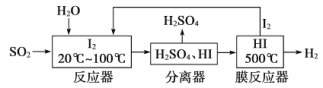
题目内容
【题目】下列与处理方法对应的反应方程式不正确的是
A.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+y/4)O2![]() xCO2+y/2H2O
xCO2+y/2H2O
C.用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D.用Na2S形成沉淀去除废水中的Hg2+:Hg2++S2-=HgS↓
【答案】C
【解析】
A.污水中投放明矾,明矾中的Al3+水解生成Al(OH)3胶体,能凝聚悬浮物,A正确;
B.烃类废气(CxHy)用高温催化氧化,可生成CO2和H2O,从而达到去除目的,B正确;
C.汽车尾气中的CO和NO,用催化法处理,应转化为对环境无害的物质,C不正确;
D.废水中的Hg2+,可加入Na2S形成HgS沉淀去除,D正确;
故选C。

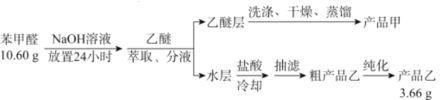
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。