��Ŀ����
����Ŀ����������������߲࣬�ԣ�ͼA������ȡ����ʱ����Ϊ߲����߲�����ĸ���ԭ������������ӽ������Ҷ���أ�ͼB���ȶ������ʣ���ش�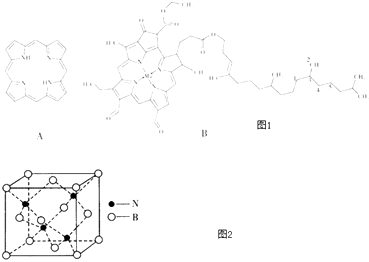
��1��߲����Nԭ�Ӳ��õĹ���ӻ���ʽ��
��2�������й�Ҷ���ط��ӵ�˵����ȷ��������ѡ����ţ���
A.ͼ1��1��5��C����������������
B.�����д�����λ��
C.ͼ1��1��2��3��4��C����
D.N�ĵ�һ�����ܴ���O
��3��߲����Fe2+�ϼ����γ�Ѫ���أ�Fe2+�ĵ����Ų�ʽΪ
��4���軯�⣨HCN����һ�ֺ����綾�����������ЦҼ���м��ĸ�����Ϊ �� �ɷ��ӽṹ�Ʋ⣬�軯������ס����ס�������ˮ��ԭ���� �� �軯���������������CN����ʹ��Ѹ���ж�����ٳ�����CN���ĵȵ����� ��
��5��N��B�ܹ��γ�һ��Ӳ�Ƚӽ����ʯ�����ʣ��侧��ṹ��ͼ2�����侧���߳�Ϊapm�������ܶ�Ϊg��cm��3��ֻ����ʽ����
���𰸡�
��1��sp3��sp2
��2��D
��3��1s22s22p63s23p63d6
��4��1��1���ף�HCN��ˮ���Ǽ��Է��ӣ�������������ԭ��֪��HCN������ˮ��N2��CO
��5��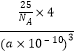
���������⣺��1���۲���ӶԸ�����4��Nԭ�Ӳ���sp3�ӻ����۲���ӶԸ�����3��N����sp2�ӻ������Դ��ǣ�sp3��sp2����2��A������̼ԭ�������ĸ���ͬ��ԭ�ӻ�ԭ���ţ��⼸��̼ԭ��ֻ��3��̼ԭ��������̼ԭ�ӣ��ʴ���B�����йµ��ӶԺͺ��пչ����ԭ��֮�������λ����Nԭ�Ӻ��йµ��Ӷԡ�����ԭ�Ӻ��пչ�������Ժ�����λ��������ȷ��C���ṹ���顢��ϩ�ṹ֪���⼸��̼ԭ��֮�䲻�ܹ��棬�ʴ���D��ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ����Ե縺��N��O������ȷ����ѡBD����3��Fe��26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ�ʧȥ�����������������������ӣ����ݹ���ԭ����д���������Ų�ʽΪ1s22s22p63s23p63d6 �� ���Դ��ǣ�1s22s22p63s23p63d6����4��HCN�ĽṹʽΪH��C��N�����۵���Ϊ�Ҽ������������к���һ���Ҽ������м����÷����к��������Ҽ������м������Զ���֮��Ϊ1��1�����Է��ӵ����ʼ������ڼ��Է��ӵ��ܼ���HCN�Ǽ��Է��ӡ�ˮ�Ǽ��Է��ӣ�����HCN������ˮԭ�Ӹ�����ȡ��۵�������ȵ�����Ϊ�ȵ����壬CN���ĵȵ�������N2��CO�ȣ����Դ��ǣ�1��1���ף�HCN��ˮ���Ǽ��Է��ӣ�������������ԭ��֪��HCN������ˮ��N2��CO����5���þ�����Nԭ�Ӹ���Ϊ4��Bԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4���仯ѧʽΪBN���ⳤΪa��10��10cm���������=��a��10��10cm��3 �� �����ܶ�=
=4���仯ѧʽΪBN���ⳤΪa��10��10cm���������=��a��10��10cm��3 �� �����ܶ�= ![]() =
= ![]() =
= 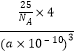 g��cm��3 �� ���Դ��ǣ�
g��cm��3 �� ���Դ��ǣ� 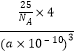 ��
��

 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�