��Ŀ����
����Ŀ��ij�����о�С�飬��ͭ��ͨ����ͬ�Ļ�ѧ��Ӧ��ȡ����������Ƶ�ʵ�����Ϊ��
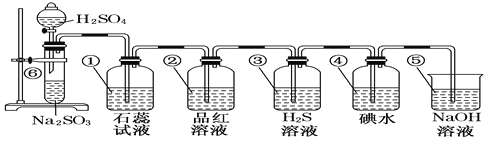
��1���������������յķ���������ʱ�õ���������________(����ĸ)��
a������ ���� b��©�� �� c����Ͳ������ d��������
��2��ͭ�۾����պ�õ��IJ���������ͭ������ͭ�Ļ����ж����к�������ͭ���ķ�����д��ʵ������������ۣ���______________________________________________________________��
��3��;�����е�������ԭ��Ӧ��ѧ����ʽ��_________________________________________________��
��4���ɴ�������ͭͨ������;����ȡ��������;������ȣ�;���������Ե�һ���ŵ���________��
���𰸡� a ȡ����������Ʒ���Թ��У��������ϡH2SO4������в�������ڣ�����жϺ�������Cu Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O ���ɵ���CuSO4��H2SO4������ �����ж�����Ⱥ�����
CuSO4��SO2����2H2O ���ɵ���CuSO4��H2SO4������ �����ж�����Ⱥ�����
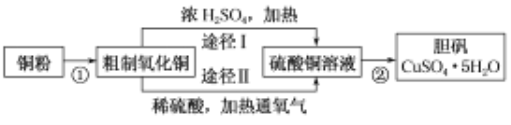
����������1������������Ҫ����������ɣ��õ�������Ϊc�������ʴ�Ϊ��c��
��2�����Ը���ͭ������ϡ������Ʒ������飬���鷽��Ϊ��ȡ������������ͭ���Թ��У��ӹ���ϡH2SO4������в�������ڣ�����жϺ�������Cu��
��3��;�����ķ�Ӧ��ͭ��Ũ������ȷ�Ӧ����Ӧ�ķ���ʽΪ��Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��4�����ݻ�ѧ����ʽ�� Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2�T2CuSO4+2H2O����;��1��ȣ�;��2�����Ե������ŵ㣬�ӷ�Ӧ��������Ͳ����е���Ⱦ����ŷŵȷ���𣬹ʴ�Ϊ��������������;�� II���������٣�;�� II���������Ⱦ������������
CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2�T2CuSO4+2H2O����;��1��ȣ�;��2�����Ե������ŵ㣬�ӷ�Ӧ��������Ͳ����е���Ⱦ����ŷŵȷ���𣬹ʴ�Ϊ��������������;�� II���������٣�;�� II���������Ⱦ������������

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�