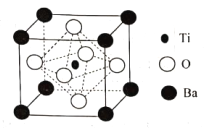
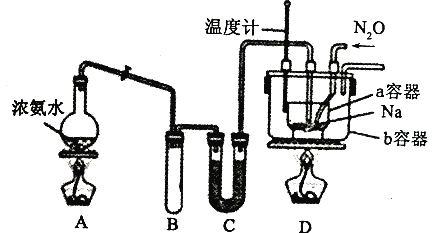
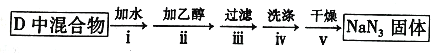
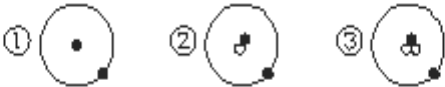
题目内容
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用C表示的反应速率是0.2 mol/(L·min)
C. 2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
【答案】B
【解析】
经2 min后,B的浓度减少了0.6mol/L,v(B)=![]() =0.3mol/(Lmin),根据化学反应速率之比等于化学计量数之比分析解答。
=0.3mol/(Lmin),根据化学反应速率之比等于化学计量数之比分析解答。
A.A为固体,不能用于表示化学反应速率,故A错误;B.v(C)∶v(B)=2∶3,故v(C)=![]() v(B)=
v(B)=![]() ×0.3mol/(Lmin)=0.2mol/(Lmin),故B正确;C.v(B) =0.3mol/(Lmin),表示2min内的平均反应速率,2min末的反应速率为瞬时速率,故C错误;D.随着反应的进行,反应物的浓度降低,反应速率减慢,浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D错误;故选B。
×0.3mol/(Lmin)=0.2mol/(Lmin),故B正确;C.v(B) =0.3mol/(Lmin),表示2min内的平均反应速率,2min末的反应速率为瞬时速率,故C错误;D.随着反应的进行,反应物的浓度降低,反应速率减慢,浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D错误;故选B。

练习册系列答案
相关题目