题目内容
【题目】下列关系式错误的是![]()
A.![]() 的水溶液:
的水溶液:![]()
B.等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液![]() ,则溶液中离子浓度:
,则溶液中离子浓度:![]()
C.![]() 某一元酸HA溶液和
某一元酸HA溶液和![]() 溶液等体积混合的溶液中:
溶液等体积混合的溶液中:![]()
D.两种弱酸HX和HY混合后,溶液中的![]() 为
为![]() 为电离平衡常数
为电离平衡常数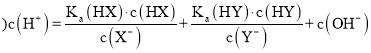
【答案】D
【解析】
A.![]() 的水溶液中,碳酸部分电离出氢离子,溶液呈酸性,由于氢离子还来自水的电离、
的水溶液中,碳酸部分电离出氢离子,溶液呈酸性,由于氢离子还来自水的电离、![]() 的电离,则
的电离,则![]() ,由于第二步电离极弱,则
,由于第二步电离极弱,则![]() ,所以该溶液中离子浓度大小为:
,所以该溶液中离子浓度大小为:![]() ,故A正确;
,故A正确;
B.等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液![]() ,则
,则![]() ,根据电荷守恒可得:
,根据电荷守恒可得:![]() ,则溶液中离子浓度大小为:
,则溶液中离子浓度大小为:![]() ,故B正确;
,故B正确;
C.![]() 某一元酸HA溶液和
某一元酸HA溶液和![]() 溶液等体积混合的溶液,反应后溶质浓度为
溶液等体积混合的溶液,反应后溶质浓度为![]() 的NaA和
的NaA和![]() 的HA,根据电荷守恒得
的HA,根据电荷守恒得![]() ,根据物料守恒得:
,根据物料守恒得:![]() ,将
,将![]() 代入
代入![]() 可得:
可得:![]() ,整理可得:
,整理可得:![]() ,故C正确;
,故C正确;
D.两种弱酸HX和HY混合后,根据二者的电离平衡常数可知溶液中的![]() 为
为![]() 为电离平衡常数
为电离平衡常数![]() :混合液中
:混合液中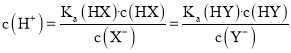 ,故D错误。
,故D错误。
故选D。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】为了更深刻地认识卤素的性质,某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
[实验一]氯气的制备
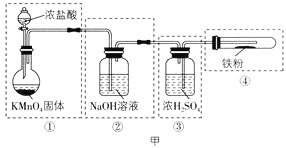
(1)该小组拟用图甲实验装置来制备纯净、干燥的氯气,并完成与金属铁的反应(夹持仪器略去)。每个虚线框表示一个单元装置,请用文字描述将下列装置的错误之处改正:___。
[实验二]探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3 +4Cl2,该化学小组选用图乙部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3 +4Cl2,该化学小组选用图乙部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
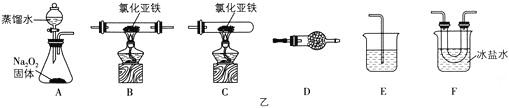
(2)实验装置的合理连接顺序为A→___→E。
(3)简述将装置F中的固体配成溶液的操作方法:___。
[实验三]卤素化合物之间反应的实验条件控制探究
(4)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组同学设计的一组实验的数据记录如下表(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20molL-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4溶液/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是___。
②2号试管反应完全后,取少量试管中的溶液,滴加淀粉溶液后显蓝色,假设还原产物只有KCl,写出反应的离子方程式:___。
【题目】下列实验操作现象以及所得到的结论均正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向2mL 10%的NaOH溶液中加入4~6滴2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
B | 在空气中加热金属铜变黑后,迅速伸入装有乙醇的试管中,金属铜恢复为原来的亮红色 | 乙醇发生了氧化反应 |
C | 向盛有苯酚浓溶液的试管中逐滴加入几滴稀溴水,边加边振荡,试管中产生了白色沉淀 | 苯酚和溴发生了取代反应生成三溴苯酚 |
D | 向10mL饱和Na2CO3溶液中加入2滴0.1mol/L的醋酸溶液,溶液中立即产生了气泡 | 醋酸酸性比碳酸强 |
A.AB.BC.CD.D