题目内容
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
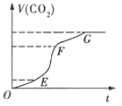
(1)实验过程如图所示,分析判断:(填“OE”、“EF”或“FG”,下同)___段化学反应速率最大,___段收集的二氧化碳气体最多。
(2)ag块状碳酸钙与足量盐酸反应,碳酸钙消耗的质量随时间的变化曲线用实线表示,在相同的条件下,将bg(a>b)粉末状碳酸钙与足量的相同浓度的盐酸反应,碳酸钙消耗的质量随时间的变化曲线用虚线表示。则图中最符合实际情况的图象是___(填序号)。
A.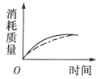 B.
B.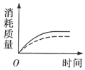 C.
C. D.
D.
(3)为了减缓题述反应的速率,下列措施中,你认为可行的是___(填序号)
A.加入蒸馏水
B.加入氯化钠固体
C.加入硝酸钾溶液
D.加入浓盐酸
E.降温
F.加入MnO2粉末
【答案】EF EF C ACE
【解析】
(1)分析题给t-V(CO2)图,OE、EF、FG三段,根据其曲线斜率以及曲线对应的CO2体积的变化值进行分析判断。
(2)增大一定量固体的表面积,可增大反应速率,据此进行分析判断。
(3)要降低反应速率,从反应速率的影响因素去考虑分析,包括:浓度、温度、催化剂、压强、接触面积等等。
(1)反应速率越大,对应曲线在图象上的斜率就越大,所以EF段化学反应速率最大;在EF段CO2体积变化也最大,即生成的CO2也最多;答案为:EF;EF;
(2)反应物的接触面积越大,反应速率越快,在相同时间内消耗碳酸钙的质量更多。又因为a大于b,盐酸足量的情况下,最终消耗碳酸钙最多的是块状碳酸钙,故刚开始反应,虚线的斜率大于实线,最终消耗的碳酸钙质量应是虚线小于实线,C项正确;答案选C;
(3)
A.加入蒸馏水,相当于稀释了盐酸,盐酸浓度降低,反应速率降低,A项正确;
B.氯化钠固体不参与反应,对反应速率没影响,B项错误;
C.硝酸钾不参与反应,加入硝酸钾溶液相当于加水稀释盐酸,盐酸浓度降低,反应速率降低,C项正确;
D.加入浓盐酸,增大了盐酸的浓度,反应速率加快,D项错误;
E.升高温度,可以加快反应速率,降低温度,反应速率降低,E项正确;
F.MnO2不参与反应,对反应速率没影响,F项错误;
故答案为:ACE。

【题目】下列实验操作现象以及所得到的结论均正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向2mL 10%的NaOH溶液中加入4~6滴2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
B | 在空气中加热金属铜变黑后,迅速伸入装有乙醇的试管中,金属铜恢复为原来的亮红色 | 乙醇发生了氧化反应 |
C | 向盛有苯酚浓溶液的试管中逐滴加入几滴稀溴水,边加边振荡,试管中产生了白色沉淀 | 苯酚和溴发生了取代反应生成三溴苯酚 |
D | 向10mL饱和Na2CO3溶液中加入2滴0.1mol/L的醋酸溶液,溶液中立即产生了气泡 | 醋酸酸性比碳酸强 |
A.AB.BC.CD.D