题目内容
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:
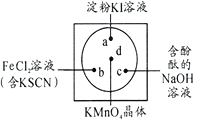
(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
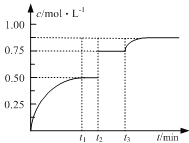
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:
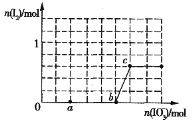
①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
【答案】+7 第四周期Ⅷ族 5 ![]() 溶液变为蓝色 红色褪去(或红色变浅) 2Fe2++Cl2→2Fe3+ +2Cl-、Fe3+ +3SCN-→Fe(SCN)3 I- IO3-+6H++5I-→3H2O+3I2 0.5或1.1
溶液变为蓝色 红色褪去(或红色变浅) 2Fe2++Cl2→2Fe3+ +2Cl-、Fe3+ +3SCN-→Fe(SCN)3 I- IO3-+6H++5I-→3H2O+3I2 0.5或1.1
【解析】
化合物中各元素化合价的代数和为零;Fe位于元素周期表的第四周期Ⅷ族;氯气能将碘离子氧化为碘单质,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,据此分析实验现象;氯气能将亚铁离子氧化为Fe3+,Fe3+与硫氰化钾反应生成络合物硫氰化铁;还原性HSO3>I-,首先发生反应:![]() ,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:
,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:![]() ,结合a点没有生成I2分析;当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:
,结合a点没有生成I2分析;当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:![]() ;二是HSO3反应完毕后,还发生反应:
;二是HSO3反应完毕后,还发生反应:![]() ,据此分析即可。
,据此分析即可。
(1)根据化学式书写原则,KMnO4中K是+1价,O是-2价,化合物中各元素化合价的代数和为零,所以Mn元素的化合价为+7;在周期表中,Fe位于第四周期Ⅷ族;
(2)第三周期原子半径最小的原子是氯离子,有5个能级,有5种不同能量的电子;长周期主族元素形成化合物是离子化合物,以碘化钾为例,电子式为:![]() ;
;
(3)高锰酸钾遇到浓盐酸会立即产生氯气,氯气能将碘离子氧化为碘单质,淀粉遇碘单质显示蓝色,故a处出现的现象为:溶液变为蓝色;氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水,次氯酸钠水解显示弱碱性,故c处出现的现象为:红色变浅或褪去;
氯气能将亚铁离子氧化为Fe3+:![]() ,Fe3+与硫氰化钾反应生成络合物硫氰化铁:
,Fe3+与硫氰化钾反应生成络合物硫氰化铁:![]() ;
;
(4)①还原性HSO3>I-,首先发生反应:![]() ,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:
,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:![]() ;由图可知,a点没有生成I2,故发生反应:
;由图可知,a点没有生成I2,故发生反应:![]() ,还原产物是I-;b点到c点发生反应的离子方程式为:
,还原产物是I-;b点到c点发生反应的离子方程式为:![]() ;
;
②当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:![]() ,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;二是HSO3反应完毕后,还发生反应:
,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;二是HSO3反应完毕后,还发生反应:![]() ,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应
,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应![]() 中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量=0.5mol×15=0.1mol,故共加入的KIO3的物质的量=1mol+0.1mol=1.1mol。
中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量=0.5mol×15=0.1mol,故共加入的KIO3的物质的量=1mol+0.1mol=1.1mol。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案