题目内容
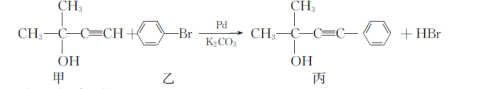
【题目】某大理石(含Fe2O3)转化为氯化钙水合物储热材料和高纯度的碳酸钙,无论从经济效益还是资源综合利用都具有重要意义。其工艺流程示意图如下。
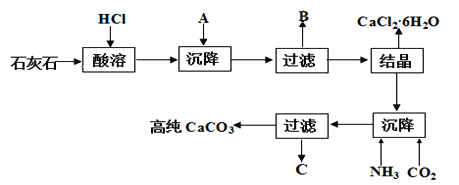
完成下列填空:
(1)上述流程中A是_________(填化学式,下同)、写出B中的成分___________。
(2)C可以作化肥,写出检验C中含有NH4+的方法:________。
(3)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____。
a 无毒
b 能导电
c 易溶于水
d 熔点较低(29℃熔化)
![]() CaCl2·6H2O
CaCl2·6H2O
(4)经过热重分析测得:CaCl2·6H2O在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则第一个相对稳定的物质的化学式是______。
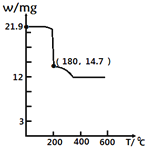
a CaCl2·4H2O
b CaCl2·2H2O
c CaCl2·H2O
d CaCl2
(5)工业还可以利用氨碱法的母液生产氯化钙。根据如图溶解度曲线,设计从含CaCl241%的饱和食盐水中,获得氯化钙水合物的流程______。
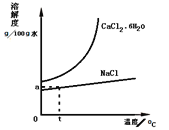
(流程示意:![]() )
)
【答案】CaCO3 CaCO3、Fe(OH)3 取滤液于洁净试管中,滴入浓氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,变蓝,则证明含有铵根离子 a,d b ![]()
【解析】
石灰石的主要成分为碳酸钙,含有Fe2O3杂质,可先加入盐酸溶解,然后加入碳酸钙,使铁离子水解生成氢氧化铁沉淀,过滤得到的滤渣为碳酸钙和氢氧化铁混合物,滤液为氯化钙溶液,结晶可得到CaCl26H2O,在沉降后的母液中通入氨气、二氧化碳,可得到碳酸钙沉淀,滤液C为氯化铵;加热到180℃时固体的质量由21.9g变为14.7g,失去部分结晶水,根据氯化钙和水的物质的量确定化学式;从含CaCl241%的饱和食盐水中,获得氯化钙水合物,由图象可以知道氯化钙的溶解度随温度升高变化较大,可蒸发结晶,趁热过滤除去氯化钠,然后冷却结晶可得到氯化钙晶体,过滤分离。据此分析。
(1)石灰石的主要成分为碳酸钙,含有Fe2O3杂质,可先加入盐酸溶解,然后加入碳酸钙,使铁离子水解生成氢氧化铁沉淀,过滤得到的滤渣为碳酸钙和氢氧化铁混合物,滤液为氯化钙溶液,结晶可得到CaCl26H2O,在沉降后的母液中通入氨气、二氧化碳,可得到碳酸钙沉淀,滤液C为氯化铵,由以上分析可以知道A为CaCO3,B为CaCO3和Fe(OH)3,答案是:CaCO3;CaCO3和Fe(OH)3;
(2)检验铵根离子,可加入浓氢氧化钠溶液,然后加热生成氨气,因氨气水溶液呈碱性,则可用湿润的红色石蕊试纸检验,变红,说明含有铵根离子;答案是:取滤液于洁净试管中,滴入浓氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,变蓝,则证明含有铵根离子;
(3)氯化钙结晶水合物(CaCl26H2O)是目前常用的无机储热材料,主要是利用无毒,熔点较低的性质,与导电性、溶解性无关;答案是:a,d;
(4)21.9gCaCl26H2O物质的量为0.1mol,m(CaCl2)=0.1mol×111g∕mol=11.1g,加热到180℃时固体的质量由21.9g变为14.7g,失去部分结晶水,则14.7g固体中含水的物质的量为:![]() ,则n(CaCl2):n(H2O)=0.1mol:0.2mol=1:2,则分子式为CaCl22H2O;答案是:b;
,则n(CaCl2):n(H2O)=0.1mol:0.2mol=1:2,则分子式为CaCl22H2O;答案是:b;
(5)从含CaCl241%的饱和食盐水中,获得氯化钙水合物,由图象可以知道氯化钙的溶解度随温度升高变化较大,可蒸发结晶,趁热过滤除去氯化钠,然后冷却结晶可得到氯化钙晶体,过滤分离,流程为![]() ;
;
答案是:![]()