题目内容
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
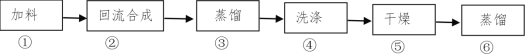
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
【答案】NaBr+H2SO4(浓)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O 浓硫酸具有强氧化性,溴离子具有还原性,部分溴化物被氧化成溴,导致产品呈红棕色 C Br2+SO32-+H2O→2Br-+2H+ +SO42- b 分液漏斗 上 取样,加入氢氧化钠溶液并加热,用稀硝酸调节到酸性,再滴入硝酸银溶液,有淡黄色沉淀产生
【解析】
(1)溴化钠与浓硫酸得到HBr,1-丁醇与HBr发生取代反应生成1-溴丁烷;浓硫酸具有强氧化性,可以将溴离子氧化为溴单质;
(2)强碱容易使1-溴丁烷水解,溴具有强氧化性,可以用还原性的NaHSO3溶液除去;
(3)碳酸氢钠溶液显弱碱性,可以除去剩余的硫酸;
(4)浓硫酸与有机物不互溶,采用分液方法分离,浓硫酸的密度比1-溴丁烷大;
(5)先在碱性条件下水解,再用硝酸酸化的硝酸银溶液检验。
(1)溴化钠与浓硫酸得到HBr,1-丁醇与HBr发生取代反应生成1-溴丁烷,反应方程式为:NaBr+H2SO4(浓)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O;浓硫酸有强氧化性,溴离子有还原性,部分溴化物被氧化成溴,导致产品往往呈红棕色;
(2)强碱容易使1-溴丁烷水解,溴具有强氧化性,可以用还原性的NaHSO3溶液除去,反应离子方程为:Br2+HSO3-+H2O=3H++SO42-+2Br-;
(3)碳酸氢钠溶液显弱碱性,最适宜除去剩余的硫酸,氢氧化钠溶液碱性太强,亚硫酸氢钠溶液反应会生成二氧化硫气体,溴化钠溶液与少量硫酸不反应,故选:b;
(4)浓硫酸与有机物不互溶,采用分液方法分离,需要用分液漏斗分离,浓硫酸的密度比1-溴丁烷大,有机层在上层;
(5)检验产物中含有溴元素的实验方法是:取少量产品样品,加入NaOH溶液并加热,用稀硝酸调至酸性,加入硝酸银溶液,产生淡黄色沉淀。