��Ŀ����
����Ŀ��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�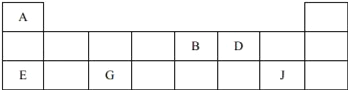
��1�������ϱ��ش����⣺
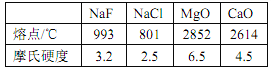
��D�����ڱ��е�λ����__��
��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����__����Ԫ�ط��ţ���
��B��D����̬�⻯����ȶ��Թ�ϵΪ__���ѧʽ����
��34Se��Dͬ���壬��ǽ����Ա�D__������ǿ����������������ԭ�ӽṹ�ĽǶȽ�����ԭ��Ϊ__��
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊ����H++OH��=H2O������_________������________��
��2����ͼ��ʾת����ϵ�еĸ���������������Ԫ�ص�һ�ֻ������ɣ����мס��ҡ�������Ϊ����Ԫ����ɵĻ�����ס����ķ�������10����������Ϊ�����ܼ�����ͼ�в��ֲ������ԣ�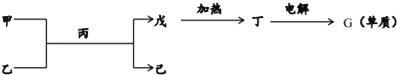
�����ʼ��к��еĻ�ѧ��������Ϊ__��
���õ���ʽ��ʾ�����ӵ��γɹ���Ϊ__��
���ɶ�����Ƶ�G���ʵĻ�ѧ��Ӧ����ʽΪ__��
���𰸡� �ڶ����ڵڢ�A�� Na��Al��N��H NH3��H2O �� λ��ͬ����������������ͬ����O�ĵ��Ӳ����٣�ԭ�Ӱ뾶С����O�õ���������Seǿ Al��OH��3+3H+=Al3++3H2O Al��OH��3+OH��=AlO2��+2H2O ���Ӽ����ۼ� ![]() 2Al2O3�����ڣ�
2Al2O3�����ڣ�![]() 4Al+3O2��
4Al+3O2��
��������(1)������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�ÿ�֪��A��B��D��E��G��J�ֱ�ΪH��N��O��Na��Al��Cl��
��O��ԭ�ӽṹ����2�����Ӳ㣬����������Ϊ6����λ�ڵڶ����ڵڢ�A�壬�ʴ�Ϊ���ڶ����ڵڢ�A�壻
�ڵ��Ӳ�Խ�࣬ԭ�Ӱ뾶Խ��ͬ���ڴ�������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶�ɴ�С��˳����Na��Al��N��H���ʴ�Ϊ��Na��Al��N��H��
�۷ǽ�����Խǿ���⻯��Խ�ȶ���B��D����̬�⻯����ȶ��Թ�ϵΪNH3��H2O���ʴ�Ϊ��NH3��H2O��
��34Se��Dͬ���壬��ǽ����Ա�D������ԭ�ӽṹ�ĽǶȽ�����ԭ��Ϊλ��ͬ����������������ͬ����O�ĵ��Ӳ����٣�ԭ�Ӱ뾶С����O�õ���������Seǿ����ͬ������ϵ��·ǽ������������ʴ�Ϊ������λ��ͬ����������������ͬ����O�ĵ��Ӳ����٣�ԭ�Ӱ뾶С����O�õ���������Seǿ��
�����������������ԣ������ᡢ�������������Ӧ�����κ�ˮ�����������ӷ�Ӧ�ֱ�ΪH++OH-=H2O��Al(OH)3+3H+=Al3++3H2O��Al(OH)3+OH-=AlO2-+2H2O���ʴ�Ϊ��Al(OH)3+3H+=Al3++3H2O��Al(OH)3+OH-=AlO2-+2H2O��
(2)�ɼס��ҡ�������Ϊ����Ԫ����ɵĻ�����ס����ķ�������10����������Ϊ�����ܼ����������Ԫ�ؼ�ת����ϵ��֪����ΪNH3����ΪH2O����ΪAlCl3����Ӧ���ɵ���ΪAl(OH)3����Ϊ��������GΪAl����ΪNH4Cl��
�����ʼ��к��еĻ�ѧ��������Ϊ���Ӽ����ۼ����ʴ�Ϊ�����Ӽ����ۼ���
���õ���ʽ��ʾ�����ӵ��γɹ���Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
���ɶ�����Ƶ�G���ʵĻ�ѧ��Ӧ����ʽΪ2Al2O3(����)![]() 4Al+3O2�����ʴ�Ϊ��2Al2O3(����)
4Al+3O2�����ʴ�Ϊ��2Al2O3(����)![]() 4Al+3O2����
4Al+3O2����

 ��У����ϵ�д�
��У����ϵ�д�