题目内容
5.现有四中物质a.NH3 b.CO2 c.H2 d.H2O,回答下列问题:(1)在四种物质的组成元素中:原子序数最小的元素形成的阴离子的电子式为[H:]-;原子序数最大的元素在周期表中的位置是第2周期ⅥA族.
(2)四种物质中分子内共用电子对数由少到多的顺序是cdab(填字母序号),所有原子的最外层均达到8个电子稳定结构的物质是b(填字母序号)
(3)实验室制取a气体的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O、制取b气体的离子方程式为CaCO3+2H++=Ca2++CO2↑+H2O;制取c气体时常在溶液中滴入少量CuSO4溶液,目的是构成原电池加快产生氢气的速率.
(4)标准状况下将4.48L的b气体通入到200ml、1.5mol/L的NaOH溶液中,完全反应后放出QKJ的热量,则该反应的热化学方程式为2CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l)△H=-10QKJ•mol-1.
分析 (1)原子序数最小的元素为H,可形成H-离子,原子序数最大为O元素;
(2)形成的共价键中,单键含有1个共用电子对,双键含有2个电子对,以此判断;形成的稳定结构中,H的最外层电子数为2;
(3)实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气;用碳酸钙和稀盐酸反应制备二氧化碳气体;用锌和稀硫酸反应制备氢气,为加快反应速率,可形成原电池反应;
(4)n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.2L×1.5mol/L=0.3mol,发生2 CO2+3NaOH=Na2CO3+NaHCO3+H2O,结合放出的热量计算反应热,可写出热化学方程式.
解答 解:(1)原子序数最小的元素为H,可形成H-离子,电子式为[H:]-,原子序数最大为O元素,原子核外有2个电子层,最外层电子数为6,则位于周期表第2周期ⅥA族,
故答案为:[H:]-;第2周期ⅥA族;
(2)a.NH3含有3个N-H键,共用电子对数为3,b.CO2的结构式为O=C=O,共用电子对数为4,c.H2中含有H-H键,共用电子对数为1,d.H2O的结构式为H-O-H,含有2个共用电子对,则共用电子对数由少到多的顺序是cdab,形成的稳定结构中,H的最外层电子数为2,则所有原子的最外层均达到8个电子稳定结构的物质是b,
故答案为:cdab;b;
(3)实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,方程式为2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,用碳酸钙和稀盐酸反应制备二氧化碳气体,反应的离子方程式为CaCO3+2H++=Ca2++CO2↑+H2O,用锌和稀硫酸反应制备氢气,加入硫酸铜,锌置换出铜,形成原电池反应,可加快反应速率,
故答案为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;CaCO3+2H++=Ca2++CO2↑+H2O;构成原电池加快产生氢气的速率;
(4)n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.2L×1.5mol/L=0.3mol,发生2 CO2+3NaOH=Na2CO3+NaHCO3+H2O,完全反应后放出QKJ的热量,可知2mol CO2参加反应可放出10QkJ的热量,故热化学方程式为2 CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l)△H=-10QKJ•mol-1,
故答案为:2 CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l)△H=-10QKJ•mol-1.
点评 本题综合考查元素的结构、位置以及性质等知识,为高频考点,题目侧重于学生的分析、计算能力的考查,注意把握核外电子排布以及热化学方程式的书写,难度不大.

| A. | F-和OH- | B. | Na+和Al3+ | C. | K+和Cl- | D. | Mg2+和S2- |
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为700℃.
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.试用平衡常数判断平衡不发生移动(填“发生”或“不发生”).
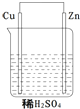 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
| A. | 吸热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 形成化学键的过程会释放能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 氧化反应均为吸热反应 |

下列关于橙花醇的叙述,错误的是( )
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇与浓氢溴酸反应,最多消耗3mol HBr | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗 480g Br2 |
| A. | 冰熔化时,分子中H-O键发生断裂 | |
| B. | HI比HF易分解,是因为HI分子间不存在氢键 | |
| C. | 非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 | |
| D. | 含有阴离子的物质一定含有阳离子 |
| A. | 不可将水直接倒入浓硫酸中进行稀释 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 硝酸与铁反应可产生H2 | |
| D. | 浓硫酸对皮肤或衣服有很强的腐蚀性 |