题目内容
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
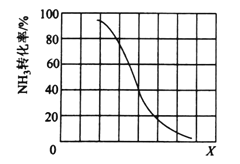
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
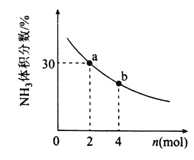
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
【答案】-76.0kJ·mol-1 11 压强 0.025mol·L-1·min-1 3/16 阳 2Cu2++2e-+H2O=Cu2O+2H+
【解析】
(1)已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1①,3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H=+18.7kJ·mol-1②,根据盖斯定律,②×2-①可得6FeO(s)+CO2(g)==2Fe3O4(s)+C(s),△H=(+18.7kJ·mol-1)×2-(+113.4kJ·mol-1)= -76.0kJ·mol-1,故答案为:-76.0kJ·mol-1。
(2)1.0mol·L-1NaClO溶液中,c(ClO-)=1.0mol·L-1,已知ClO-+H2O![]() HClO+OH-,该水解反应的平衡常数K=c(HClO)c(OH-)/c(ClO-)=c2(OH-)=1.0×10-6mol·L-1,c(OH-)=1.0×10-3mol·L-1,则c(H+)=Kw/c(OH-)=10-14/10-3=10-11,则pH=11,故答案为:11。
HClO+OH-,该水解反应的平衡常数K=c(HClO)c(OH-)/c(ClO-)=c2(OH-)=1.0×10-6mol·L-1,c(OH-)=1.0×10-3mol·L-1,则c(H+)=Kw/c(OH-)=10-14/10-3=10-11,则pH=11,故答案为:11。
(3)①根据图示,X越大转化率越小,平衡逆向移动,该反应为吸热反应,温度升高平衡正向移动,增大压强,平衡逆向移动,故答案为:压强。
②设10min时,反应的氨气的物质的量为x,
CH4(g)+NH3(g)![]() HCN(g)+3H2(g)
HCN(g)+3H2(g)
开始(mol) 2 2 0 0
反应(mol) x x x 3x
a点(mol) 2-x 2-x x 3x
则(2-x)/(2-x+x+3x)×100%=30%,解得x=0.5mol,
v(CH4)=△c/△t=0.5mol/2L/10min=0.025mol·L-1·min-1,
此时c(HCN)=0.5mol/2L=0.25mol/L,c(H2)=0.5mol×3/2L=0.75mol/L,c(CH4)=c(NH3)=(2-0.5)mol/2L=0.75mol/L,
平衡常数只与温度有关,所以Ka=Kb=c(HCN)c3(H2)/c(CH4)c(NH3)=0.25×(0.75)3/0.75×0.75=3/16,故答案为:0.025mol·L-1·min-1,3/16。
(4)要生成氧化亚铜,则铜必须失去电子,因此铜作阳极。阴极得到电子,发生还原反应,所以阴极电极反应式为2Cu2++2e-+H2O=Cu2O+2H+,
故答案为:阳,2Cu2++2e-+H2O=Cu2O+2H+。

 阅读快车系列答案
阅读快车系列答案